
| A. | 浓硫酸的稀释 | B. | 铝热反应 | ||
| C. | 氢气还原氧化铜 | D. | 氢氧化钡晶体与氯化铵晶体混合 |
分析 根据常见的放热反应有:所有的物质燃烧、所有金属与酸反应、金属与水反应,所有中和反应;绝大多数化合反应和铝热反应;
常见的吸热反应有:绝大数分解反应,个别的化合反应(如C和CO2),少数分解置换以及某些复分解(如铵盐和强碱),C或氢气做还原剂时的反应.
解答 解:A.浓硫酸的稀释是物理变化,故A错误;
B.铝热反应是放热反应,故B正确;
C.氢气还原氧化铜的反应是吸热反应,故C错误;
D.氢氧化钡晶体与氯化铵晶体的反应是吸热反应,故D错误.
故选B.
点评 本题考查放热反应,抓住中学化学中常见的吸热或放热的反应是解题的关键,对于特殊过程中的热量变化的要熟练记忆来解答此类习题,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25 | B. | 0.025 | C. | 30.25 | D. | 27.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 元素 | A | B | C | D | E |
| 性质 或结 构信 息 | 室温下单质呈气态,原子最外层电子数与D相同 | D3B中阳离子与阴离子的电子层结构相同 | A和C可形成两种常见的化合物甲和乙,甲有强氧化性 | 单质质软、银白色固体、导电性强,在空气中燃烧生成淡黄色固体 | E的气态氢化物和最高价氧化物对应的水化物均为强酸,C、D和E三种元素形成的一种盐丙为某消毒液的主要成分 |
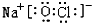 .丙在水溶液中的电离方程式NaClO=Na++ClO-.
.丙在水溶液中的电离方程式NaClO=Na++ClO-.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅原子和钠原子 | B. | 硼原子和氦原子 | C. | 氯原子和碳原子 | D. | 碳原子和铝原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价] | +2 | +3 | +2 | +6、-2 | -2 |
| A. | 氢化物的沸点为H2T<H2R | B. | 单质与稀盐酸反应的速率为L<Q | ||
| C. | L2+与R2-的核外电子数相等 | D. | M与T形成的化合物具有两性 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 2,3,4,5-四甲基己烷
2,3,4,5-四甲基己烷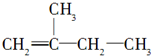 2-甲基-1丁烯
2-甲基-1丁烯 .
. .
. 分子式为C10H20,按碳的骨架分,该有机物属于ab.(填字母序号)
分子式为C10H20,按碳的骨架分,该有机物属于ab.(填字母序号)查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com