
| c(B) |
| c(OH-) |
| c(OH-) |
| c(H+) |
| c(B-) |
| c(OH-) |
| c(NH3?H2O) |
| c(OH-) |
| c(OH-) |
| c(H+) |


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:
| A、用电解法精炼粗铜的时候纯铜做阳极 |
| B、将镁块与钢铁输水管相连,可以防止钢铁腐蚀 |
| C、熔融烧碱的时候,不能使用石英坩埚 |
| D、可以用硫酸或者CO2中和碱性废水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:1 | B、2:1 |
| C、2:3 | D、3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(H+) |
| c(CH3COOH) |
| A、加少量烧碱溶液 |
| B、加入金属锌 |
| C、加少量冰醋酸 |
| D、加水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,pH=7的NH4Cl与氨水的混合溶液中:c(Clˉ)>c(NH4+)>c(H+)=c(OHˉ) | ||
| B、在0.1mol?L-1 的NaHA溶液pH=4,则H2A为强酸 | ||
| C、pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊呈红色 | ||
D、向0.1mol?L-1的氨水中加少量硫酸铵固体,则溶液中
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:


 (苯胺,易被氧化)
(苯胺,易被氧化) 有多种同分异构体,写出同时符合下列4个条件它的同分异构体的结构简式:
有多种同分异构体,写出同时符合下列4个条件它的同分异构体的结构简式: 的流程图:
的流程图: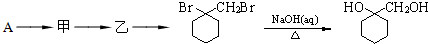 完成甲→乙的化学反应方程式:
完成甲→乙的化学反应方程式:
 为原料
为原料 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:| HBr |
| NaOH溶液 |
| △ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com