

���� ��ͭ�к���Fe����������Ӧ����CuCl2��FeCl3��Ϊ��ֹˮ�⣬Ӧ���������ϡ��������ܽ⣬����֤������ȫ��Ӧ����Һ1�еĽ���������Fe3+��Fe2+��Cu2+�������Լ�XĿ���ǽ���Һ��Fe2+����ΪFe3+��ӦΪH2O2����ԭ�õ�ˮ������ɫ��������ͨ������pH��ʹ��Һ��Fe3+ת��ΪFe��OH��3���������˷��룬�Ҽ���Y���������������Ҳ������������ʣ�����ΪCuO��Cu��OH��2��CuCO3��Cu2��OH��2CO3����Һ��������Ũ������ȴ�ᾧ�����ˡ�ϴ�ӡ�����õ�CuCl2•2H2O��
��1��Fe2+���л�ԭ�ԣ�����ʹ���Ը��������Һ��ɫ������K3[Fe��CN��6]��Ӧ�õ���ɫ���軯������ɫ������
��2������pH��4��5֮�䣬Һ��Fe3+ת��ΪFe��OH��3������Cu2+���Ӳ����������˷��룻
��3������ʵ������480mL10mol/LŨHClʱ�õ��IJ��������У���Ͳ�����������ձ���500mL����ƿ��
��4��CuCl2•xH2O����������ֽ⣬���Ȼ�ͭ��ˮ�⣬Ӧ��HCl�����е��º�ɣ�
��5��������ͭ���ȷֽ����ú�ɫ���������ngΪCuO������CuԪ���غ����CuCl2•xH2O�����ʵ������ٽ��m=nM����x��ֵ��
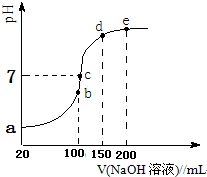
��6����a��b��c��d��e����㣬���ݷ�Ӧ���Ĺ�ϵ��b��ǡ��������H+����Һ��ֻ�У�NH4��2SO4��Na2SO4��
��c����Һ�����ԣ�����Һ���У�NH4��2SO4��Na2SO4��NH3•H2O���ֳɷ֣�
�۸��ݼ�����Һ�У�����������Ũ��Խ��ˮ�ĵ���̶�ԽС���з�����
��� �⣺��ͭ�к���Fe����������Ӧ����CuCl2��FeCl3��Ϊ��ֹˮ�⣬Ӧ���������ϡ��������ܽ⣬����֤������ȫ��Ӧ����Һ1�еĽ���������Fe3+��Fe2+��Cu2+�������Լ�XĿ���ǽ���Һ��Fe2+����ΪFe3+��ӦΪH2O2����ԭ�õ�ˮ������ɫ��������ͨ������pH��ʹ��Һ��Fe3+ת��ΪFe��OH��3���������˷��룬�Ҽ���Y���������������Ҳ������������ʣ�����ΪCuO��Cu��OH��2��CuCO3��Cu2��OH��2CO3����Һ��������Ũ������ȴ�ᾧ�����ˡ�ϴ�ӡ�����õ�CuCl2•2H2O��
��1����Fe2+���л�ԭ�ԣ�����ʹ���Ը��������Һ��ɫ���ø��������Һ���Լ���Fe2+������ȷ��
��Fe2+����K3[Fe��CN��6]��Ӧ�õ���ɫ���軯������ɫ����������ȷ��
�������ӡ�ͭ���Ӿ���NaOH��Ӧ���ɳ�����Ӱ���������Ӽ��飬�ʴ���
����������KSCN��Ӧ����Һ�ʺ�ɫ�����ܼ���Fe2+���ʴ���
��ѡ���٢ڣ�
��2��������������֪���Լ�XΪ���ᣬ������������ᣬ��ַ�Ӧ������Cu2+ˮ�⣻����Y�������������ӵ�����ҺpH��ʹ��Һ��Fe3+ת��ΪFe��OH��3���������˷��룬�Ҳ������������ʣ�
a��NaOH�������������ӣ���a����
b��NH3•H2O ����笠����ӣ���b����
c��CuO���Ե���PHֵ����ȥ���ʣ�������CuO���˳�ȥ�����������ʣ���c��ȷ��
d��Cu2��OH��2CO3 ���Ե���PHֵ����ȥ���ʣ�������Cu2��OH��2CO3 ���˳�ȥ�����������ʣ���d��ȷ��
e��CuSO4���ܵ���PHֵ��������������ӣ���e����
����pH��4��5֮�䣬ʹ��Һ��Fe3+ת��ΪFe��OH��3������Cu2+���Ӳ�������
�ʴ�Ϊ��cd��ʹ��Һ��Fe3+ת��ΪFe��OH��3������Cu2+���Ӳ�������
��3������ʵ������480mL10mol/LŨHClʱ�õ��IJ��������У���Ͳ�����������ձ�����ͷ�ιܡ�500mL����ƿ��
�ʴ�Ϊ����ͷ�ιܡ�500mL����ƿ��
��4��CuCl2•xH2O����������ֽ⣬���Ȼ�ͭ��ˮ�⣬Ӧ��HCl�����е��º�ɣ�
�ʴ�Ϊ��D��
��5��������ͭ���ȷֽ����ú�ɫ���������ngΪCuO������CuԪ���غ㣺n��CuCl2•xH2O��=n��CuO��=$\frac{n}{80}$mol����$\frac{n}{80}$mol����135+18x��=mg�����x=$\frac{80m-135n}{18n}$��
�ʴ�Ϊ��$\frac{80m-135n}{18n}$��
��6����a��b��c��d��e����㣬���ݷ�Ӧ���Ĺ�ϵ��b��ǡ��������H+����Һ��ֻ�У�NH4��2SO4��Na2SO4����Һ�з���ˮ�ⷴӦ��������NH4+��
�ʴ�Ϊ��NH4+��
��c����Һ�����ԣ�����Һ���У�NH4��2SO4��Na2SO4��NH3•H2O���ֳɷ֣�b��ʱc��Na+��=c��SO42-����c��ʱc��Na+����c��SO42-��������NԪ����SԪ�صĹ�ϵ�����Եó�c��SO42-����c��NH4+������Һ������Ũ�ȴ�СΪ��c��Na+����c��SO42-����c��NH4+����c��OH-��=c��H+����
�ʴ�Ϊ��c��Na+����c��SO42-����c��NH4+����c��OH-��=c��H+����
��d��e��Һ��Ϊ������Һ����Һ�е�����������������ˮ�ĵ��룬������������Һ���Խ��ˮ�ĵ������ԽС����d��ˮ�ĵ���̶ȴ���e��ˮ�ĵ��룬
�ʴ�Ϊ������
���� ���⿼�黯ѧ�������̼�ʵ���Ʊ����漰��ʵ��װ����������Լ��ķ������ۡ����ʷ����ᴿ����ѧƽ���ƶ�����ѧ����ȣ�Ҫ��ѧ���߱���ʵ�Ļ������ۺ������������ѶȺܴ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��֪H2CO3��Ka1=4.2��10-7��Ka2=5.6��10-11��HClO��Ka=3.0��10-8��HF��Ka=3.5��10-4��
��֪H2CO3��Ka1=4.2��10-7��Ka2=5.6��10-11��HClO��Ka=3.0��10-8��HF��Ka=3.5��10-4���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | CH4 | B�� | C2H6 | C�� | C2H4 | D�� | C2H2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ������ | Fe��OH��3 | Fe��OH��2 | Al��OH��3 | ������ | Fe��OH��3 | Fe��OH��2 | Al��OH��3 |
| ��ʼ���� | 2.3 | 7.5 | 3.4 | ��ȫ���� | 3.2 | 9.7 | 4.4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 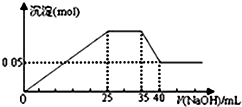 ��ͼ��ʾ��Mg2+��Al3+��NH4+������Һ�еμ�NaOH��Һʱ������������NaOH�������ϵͼ�����������ӵ����ʵ���֮��Ϊ��n��Mg2+����n��Al3+����n�� NH4+��=2��1��2������ʹ�õ�NaOH��Ũ��Ϊ2 mol•L-1 | |
| B�� |  ��ͼ�����߱�ʾij��Ӧ���̵������仯��������A��g����B��g����Ӧ��������C��g���ǣ���H��0����ʹ����������Eֵ���С | |
| C�� | 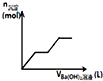 ��ͼ��������ʾ�������ữ��MgSO4��Һ�м���Ba��OH��2��Һʱ���������������ʵ�����n�������Ba��OH��2��Һ�����V��֮��Ĺ�ϵͼ | |
| D�� | 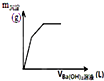 ��ͼ��ʾ��һ��������������Һ�еμ�Ba��OH��2��Һʱ������������������m�������Ba��OH��2��Һ�����V��֮��Ĺ�ϵͼ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ۢݢޢ� | B�� | �ڢۢܢݢ� | C�� | �٢ܢݢޢ� | D�� | �٢ۢݢޢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Һʱ����Һ©�����²�Һ����¿ڷų����ϲ�Һ����Ͽڵ��� | |
| B�� | ����ʱ��Ӧʹ�¶ȼ�ˮ����������ƿ��֧�ܿڴ� | |
| C�� | ����ʱ��Ӧʹ������е�ˮ����ȫ���ɺ���ֹͣ���� | |
| D�� | ����ʱ��Ҫ������ˮ��û����2-3�Σ��Գ�ȥ���ܸ����ڳ����ϵ����� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com