
| A. | 用饱和食盐水替代水跟电石作用,可以有效控制产生乙炔的速率 | |
| B. | 制肥皂时,在皂化液里加入饱和食盐水,能够促进高级脂肪酸钠的析出 | |
| C. | 实验室制取乙烯时将温度计的水银球放在反应液面上,温度 170℃时收集气体 | |
| D. | 重结晶法提纯苯甲酸时,为除去杂质和防止苯甲酸析出,应该趁热过滤 |
分析 A.饱和食盐水与电石反应平稳;
B.皂化液里加入饱和食盐水,降低高级脂肪酸钠的溶解度;
C.制取乙烯时,测量反应体系的温度;
D.趁热过滤,减少苯甲酸的损失.
解答 解:A.饱和食盐水与电石反应平稳,则用饱和食盐水替代水跟电石作用,可以有效控制产生乙炔的速率,故A正确;
B.皂化液里加入饱和食盐水,降低高级脂肪酸钠的溶解度,发生盐析,促进高级脂肪酸钠的析出,故B正确;
C.实验室制取乙烯时,将温度计的水银球插入反应液中,测量反应体系的温度,故C错误;
D.趁热过滤,减少苯甲酸的损失,则重结晶法提纯苯甲酸时,为除去杂质和防止苯甲酸析出,应该趁热过滤,故D正确;
故选C.
点评 本题考查化学实验方案的评价,涉及气体的制取、盐析、混合物的分离、提纯等,选项D为解答的易错点,题目难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
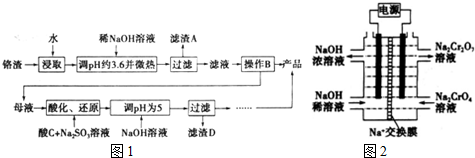
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
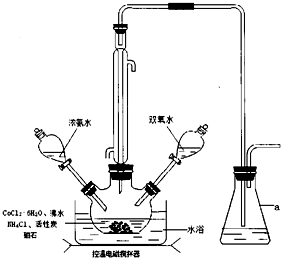
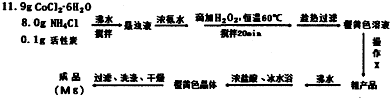
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
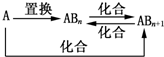
| A. | 图中物质间的转化都不是氧化还原反应 | |
| B. | 当n=1时,A可能是N2 | |
| C. | A一定是金属元素 | |
| D. | 当n=2时,A可能是Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳的燃烧热等于110.5KJ/mol | |
| B. | 2C(s)+2O2(g)=2CO2(g);△H>-221 KJ/mol | |
| C. | 浓硫酸与稀NaOH溶液反应的中和热为-57.3 KJ/mol | |
| D. | 稀醋酸与稀NaOH溶液反应生成1 mol水,放出热量小于57.3 KJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
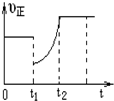 某温度下,将等物质的量A、B、C、D四种物质混合于一恒容密闭容器中,发生如下反应:aA(g)+bB(g)?cC(g)+dD(g)△H<0.当反应进行一段时间后,测得A减少了n mol,B减少了0.5n mol,C增加了1.5n mol,D增加了n mol,此时达到化学平衡状态则下列说法正确的是( )
某温度下,将等物质的量A、B、C、D四种物质混合于一恒容密闭容器中,发生如下反应:aA(g)+bB(g)?cC(g)+dD(g)△H<0.当反应进行一段时间后,测得A减少了n mol,B减少了0.5n mol,C增加了1.5n mol,D增加了n mol,此时达到化学平衡状态则下列说法正确的是( )| A. | 达到化学平衡时A的消耗速率与C的消耗速率相等 | |
| B. | 保持温度不变,再向容器中充入n mol A 和0.5n mol B,平衡不移动 | |
| C. | 保持温度不变,再向容器中充入n mol A 和n mol B,A、B的转化率均不变 | |
| D. | 图象中表示该反应的正反应速率随时间的变化情况,t1时刻可能是减少了A的浓度,增加了C的浓度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com