
【题目】25℃时,三种酸的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
回答下列问题:
(1)一般情况下,当温度升高时,Ka___(填“增大”、“减小”或“不变”)。
(2)下列四种离子结合质子能力由大到小的顺序是___(填序号)。
a.CO32- b.ClO- c.CH3COO- d.HCO3-
(3)用蒸馏水稀释0.1mol/L的醋酸,下列各式表示的数值随水量的增加而增大的是___(填序号)。
a.![]() b.
b.![]()
c. ![]() d.
d.![]()
(4)常温下,0.1mol/LNaHCO3溶液的pH大于8,则溶液c(H2CO3)___c(CO32-)(填“>、<或=”),原因是___。
(5)25℃时,若测得CH3COOH与CH3COONa的混合溶液的pH=6,则溶液中:
①![]() =___(填“精确数值”,下同)。
=___(填“精确数值”,下同)。
②c(CH3COO-)-c(Na+)=___mol/L。
【答案】增大 a>b>d>c b > HCO3-水解程度大于电离程度 18 9.9×10-7
【解析】
(1)弱电解质电离是吸热的,升高温度,会促进电离,电离平衡常数Ka增大;
(2)酸电离出H+能力越弱,那么其对应的酸根阴离子结合H+能力越强,从表中数据可以看出,HCO3-电离出H+能力最弱,则CO32-结合H+能力最强;最弱的为CH3COO-,ClO-大于HCO3-,所以四种离子结合质子能力由大到小的顺序是a>b>d>c;
(3)用蒸馏水稀释0.1mol/L的醋酸,促进醋酸的电离,但是溶液的酸性减弱;
a.上下同时乘以溶液的体积,有![]() ,加水稀释,醋酸的电离被促进,n(CH3COOH)减小,n(H+)增大,则
,加水稀释,醋酸的电离被促进,n(CH3COOH)减小,n(H+)增大,则![]() 减小,a不符合题意;
减小,a不符合题意;
b.上下同时乘以溶液的体积,有![]() ,加水稀释,醋酸的电离被促进,n(CH3COOH)减小,n(CH3COO-)增大,则
,加水稀释,醋酸的电离被促进,n(CH3COOH)减小,n(CH3COO-)增大,则![]() 增大,b符合题意;
增大,b符合题意;
c.在溶液中,Kw=c(H+)c(OH-),则![]() ,用水稀释醋酸,溶液的酸性减弱,c(OH-)增大,则
,用水稀释醋酸,溶液的酸性减弱,c(OH-)增大,则![]() 减小,c不符合题意;
减小,c不符合题意;
d.用水稀释醋酸,溶液的酸性减弱,c(OH-)增大,c(H+)减小,则![]() 减小,d不符合题意。
减小,d不符合题意。
答案选b;
(4)NaHCO3在溶液中电离出HCO3-,HCO3-即可以电离又可以水解,其电离和水解的方程式分别为HCO3-![]() H++CO32-,HCO3-+H2O
H++CO32-,HCO3-+H2O![]() H2CO3+OH-,从方程式可知,HCO3-电离使得溶液显酸性,水解使得溶液显碱性;现NaHCO3溶液显碱性,说明HCO3-的水解程度大于其电离程度,水解产生的H2CO3多余电离产生的CO32-,则c(H2CO3)>c(CO32-),原因是HCO3-水解程度大于电离程度;
H2CO3+OH-,从方程式可知,HCO3-电离使得溶液显酸性,水解使得溶液显碱性;现NaHCO3溶液显碱性,说明HCO3-的水解程度大于其电离程度,水解产生的H2CO3多余电离产生的CO32-,则c(H2CO3)>c(CO32-),原因是HCO3-水解程度大于电离程度;
(5)①醋酸的电离方程式为CH3COOH![]() CH3COO-+H+,其电离平衡常数
CH3COO-+H+,其电离平衡常数![]() ,则
,则![]() ,pH=6,c(H+)=10-6mol·L-1,K=1.8×10-5,带入数值
,pH=6,c(H+)=10-6mol·L-1,K=1.8×10-5,带入数值![]() ;
;
②在混合溶液中,根据电荷守恒,有c(H+)+c(Na+)=c(CH3COO-)+c(OH-),则c(CH3COO-)-c(Na+)=c(H+)-c(OH-),溶液pH=6,则c(H+)=10-6mol·L-1,c(OH-)=10-8mol·L-1,带入数据,得c(CH3COO-)-c(Na+)=10-6mol·L-1-10-8mol·L-1=9.9×10-7mol·L-1。


科目:高中化学 来源: 题型:
【题目】最近我国成功研制出高效电催化固氮催化剂Mo2N,如图所示,在0.1mol·L-1盐酸溶液中,在一定电压下具有较高的产氨速率和稳定的电流效率。下列判断错误的是
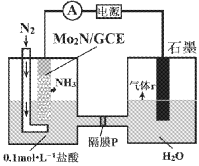
A. 石墨电极为阳极
B. P为阳离子交换膜
C. Mo2N/GCE电极区反应式为N2+6H++6e-=2NH3
D. 为提高溶液的导电性,可在石墨电极区加入适量的盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸亚铁晶体![]() 是一种黄色难溶于水的固体,受热易分解,是生产锂电池、涂料、着色剂以及感光材料的原材料。
是一种黄色难溶于水的固体,受热易分解,是生产锂电池、涂料、着色剂以及感光材料的原材料。
I、制备草酸亚铁晶体:
![]() 称取硫酸亚铁铵晶体
称取硫酸亚铁铵晶体![]() ,放入
,放入![]() 三颈烧瓶中,加入10滴左右
三颈烧瓶中,加入10滴左右![]() 溶液和
溶液和![]() 蒸馏水加热溶解;
蒸馏水加热溶解;
![]() 加入
加入![]() 饱和草酸溶液,加热搅拌至沸,停止加热,静置;
饱和草酸溶液,加热搅拌至沸,停止加热,静置;
![]() 待黄色晶体
待黄色晶体![]() 沉淀后倾析,洗涤,加入约
沉淀后倾析,洗涤,加入约![]() 蒸馏水搅拌并温热
蒸馏水搅拌并温热![]() ,静置,弃去上层清液,即得黄色草酸亚铁晶体。
,静置,弃去上层清液,即得黄色草酸亚铁晶体。
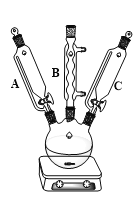
回答下列问题:
(1)仪器C的名称是_____________;仪器B的作用是_____________
(2)硫酸亚铁铵晶体用硫酸溶解的原因是 _____________________
II、探究草酸亚铁的纯度:
![]() 准确称取
准确称取![]() 草酸亚铁固体样品
草酸亚铁固体样品![]() 含有草酸铵杂质
含有草酸铵杂质![]() ,溶于
,溶于![]() 溶液中,在
溶液中,在![]() 水浴加热,用
水浴加热,用![]() 容量瓶配成
容量瓶配成![]() 溶液;
溶液;
![]() 取上述溶液
取上述溶液![]() ,用
,用![]() 标准溶液
标准溶液![]() 浓度为
浓度为![]() 滴定三次,平均消耗
滴定三次,平均消耗![]() ;
;
![]() 加入适量锌粉和
加入适量锌粉和![]() 溶液,反应一段时间后,取1滴试液放在点滴板上检验,至
溶液,反应一段时间后,取1滴试液放在点滴板上检验,至![]() 极微量;
极微量;
![]() 过滤除去锌粉,滤液收集在另一个锥形瓶中,将滤纸及残余物充分洗涤,洗涤液并入滤液中,再补充约
过滤除去锌粉,滤液收集在另一个锥形瓶中,将滤纸及残余物充分洗涤,洗涤液并入滤液中,再补充约![]() 溶液,继续用
溶液,继续用![]() 标准溶液
标准溶液![]() 浓度为
浓度为![]() 滴定至终点,共平行测定三次,平均消耗
滴定至终点,共平行测定三次,平均消耗![]() 。
。
回答下列问题:
(3)在![]() 中溶液中发生
中溶液中发生![]() ,还有另一氧化还原反应,写出其离子方程式_______________________,用
,还有另一氧化还原反应,写出其离子方程式_______________________,用![]() 标准溶液滴定至终点的现象是__________________。
标准溶液滴定至终点的现象是__________________。
(4)加入适量锌粉的目的是______________________________________;步骤![]() 中检验其中微量的
中检验其中微量的![]() 的试剂名称是______________溶液
的试剂名称是______________溶液
(5)计算![]() 固体样品的纯度为______________
固体样品的纯度为______________![]() 用含c、
用含c、![]() 、
、![]() 的式子表示,不必化简
的式子表示,不必化简![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在密闭容器中发生如下反应2A(g)+B(g)![]() 2C(g),若开始时充入2molC气体,达到平衡时,混合气体的压强比起始时增大了20%;若开始时只充入2molA和1molB的混合气体,达到平衡时A的转化率为( )
2C(g),若开始时充入2molC气体,达到平衡时,混合气体的压强比起始时增大了20%;若开始时只充入2molA和1molB的混合气体,达到平衡时A的转化率为( )
A.20%B.40%C.60%D.80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上,煤的气化和液化是高效、清洁、综合利用煤炭的重要途径。
(1)一定条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器发生反应:C(s)+2H2O(g)![]() CO2(g)+2H2(g) ΔH1>0,相关数据如下表:
CO2(g)+2H2(g) ΔH1>0,相关数据如下表:
容器 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol | |
C(s) | H2O(g) | H2(g) | |||
甲 | 2 | T1 | 3 | 4 | 3.2 |
乙 | 1 | T2 | 1.5 | 2 | 1.2 |
①T1___T2(填“>、<或=”)。
②T1时达到平衡后再加入1molH2O(g),达到新平衡后H2(g)的物质的量分数___(填“增大”“不变”或“减小”);T2时,若起始时乙容器中加入1.5molC(s)、1.2molH2O(g)、0.5molCO2(g)、1.4molH2(g),此时v正___v逆(填“>、<或=”)。
(2)煤液化时发生反应:CO(g)+2H2(g)![]() CH3OH(g)ΔH2,在10L恒容密闭容器中按物质的量之比1:2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如图所示,200℃时,n(H2)随时间的变化如下表所示:
CH3OH(g)ΔH2,在10L恒容密闭容器中按物质的量之比1:2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如图所示,200℃时,n(H2)随时间的变化如下表所示:

t/min | 0 | 1 | 3 | 5 |
n(H2)/mol | 8.0 | 5.4 | 4.0 | 4.0 |
①ΔH2___0(填“>、<或=”)。
②下列说法正确的是___(填标号)。
a.温度越高,该反应的平衡常数越大
b.达平衡后再充入稀有气体,CO的转化率提高
c.容器内气体压强不再变化时,反应达到最大限度
d.图中压强P1<P2
③0-3min内用CH3OH表示的反应速率v(CH3OH)=___mol/(L·min)(结果保留两位有效数值)。
④200℃时,该反应的平衡常数K=___。向上述200℃达到平衡的恒容密闭容器中再加入2molCO、2molH2、2molCH3OH,保持温度不变,则化学平衡___(填“正向”、“逆向”或“不”)移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X是某金属单质,X、A、B、C含同一种元素,可发生如下转化:
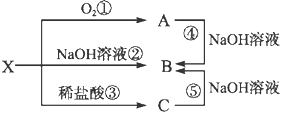
(1)写出以下反应的离子方程式:
②___________________________;
④___________________________。
(2)确定化学式B_______ X_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列说法中正确的是( )
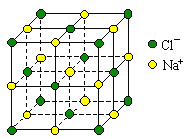
A.1L 1 mol·L-1的醋酸溶液中离子总数为2NA
B.0.05 mol碳酸钠晶体中含离子总数大于0.15NA
C.0.4mol NaCl晶体中含有右图所示的结构单元的数目为0.1NA
D.标准状况下,22.4L CH3Cl和CHCl3的混合物所含有分子数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下。

下列说法不正确的是
A. 生成CH3COOH总反应的原子利用率为100%
B. CH4→CH3COOH过程中,有C―H键发生断裂
C. ①→②放出能量并形成了C―C键
D. 该催化剂可有效提高反应物的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a mol FeS与b mol FeO投入V L c mol·L-1的HNO3溶液(过量)中,充分反应,产生气体为NO,则反应后溶液中NO3-的量为( )
A.62(a+b) gB.186(a+b) gC.![]() molD.
molD.![]() mol
mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com