
| A、1 mol Na2O2与水反应转移电子数为NA |
| B、0.1 mol FeCl3水解制成胶体,所碍胶体粒子数为0.1NA |
| C、标准状况下,22 4 L水中含有水分子数为NA |
| D、1 L 0.1 mol?L-1乙酸溶液中H+数为0.1NA |


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 盐酸在中学化学占有重要的地位,实验室有一未知浓度的盐酸溶液.
盐酸在中学化学占有重要的地位,实验室有一未知浓度的盐酸溶液.| 实验编号 | 1 | 2 | 3 |
| 滴入NaOH溶液的体积(mL) | 21.90 | 19.95 | 20.05 |
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
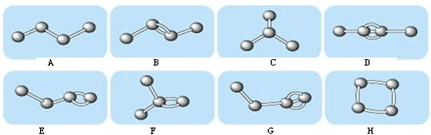
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K2CO3和K2O都属于盐 |
| B、H2SO4和NaHSO4都属于酸 |
| C、KOH和NH3?H2O都属于碱 |
| D、Na2O和Na2SiO3都属于氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知反应2SO2(g)+O2(g)?2SO3(g)△H=-198kJ?mol-1,向某体积恒定的密闭容器中充入1mol SO2和0.5molO2,在一定条件下发生反应,下图是某物理量(Y)随时间(t)变化的示意图,下列说法正确的是( )
已知反应2SO2(g)+O2(g)?2SO3(g)△H=-198kJ?mol-1,向某体积恒定的密闭容器中充入1mol SO2和0.5molO2,在一定条件下发生反应,下图是某物理量(Y)随时间(t)变化的示意图,下列说法正确的是( )| A、温度T2>T1 |
| B、反应达到平衡后放出99 kJ的热量 |
| C、Y可能是SO2的转化率或SO3的浓度 |
| D、反应达到平衡后容器内气体的密度减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、③⑤⑥⑦ | B、③⑤⑥ |
| C、①②④⑦ | D、①③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com