
将一定质量的镁、铝合金,投入100mL一定浓度的盐酸中,合金完全溶解.向所得溶液中滴加5mol/L NaOH溶液,生成的沉淀质量与加入NaOH溶液体积如图所示,由图中数据分析计算:
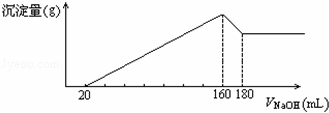
①原合金中镁的质量为g
②铝的质量为g
③盐酸的物质的量浓度为mol/L.
| 镁、铝的重要化合物;有关混合物反应的计算. | |
| 专题: | 图示题. |
| 分析: | 由图可知,从开始至加入NaOH溶液20mL,没有沉淀生成,说明原溶液中盐酸溶解Mg、Al后盐酸有剩余,此时发生的反应为:HCl+NaOH=NaCl+H2O. 继续滴加NaOH溶液,到氢氧化钠溶液为160mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,溶液为氯化钠溶液.再继续滴加NaOH溶液,氢氧化铝与氢氧化钠反应生成偏铝酸钠与水,发生反应Al(OH)3+NaOH=NaAlO2+2H2O. ①由图可知,从加入20m氢氧化钠溶液L开始产生沉淀 ②根据Al原子守恒有n(Al)=n[Al(OH)3],m=nM计算Al的质量; ③加入氢氧化钠溶液为160mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,溶液为氯化钠溶液,根据钠元素守恒此时溶液中n(NaCl)=n(NaOH),据此计算出n(HCl),再利用c= |
| 解答: | 解:①由图可知,从加入20m氢氧化钠溶液L开始产生沉淀,加入氢氧化钠溶液为160mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,该阶段消耗氢氧化钠140mL,由氢氧根守恒可知3n[Al(OH)3]+2n[Mg(OH)2]=n(NaOH)=(0.16L﹣0.02L)×5mol/L=0.7mol.从加入氢氧化钠溶液160mL~180mL溶解氢氧化铝,该阶段发生反应Al(OH)3+NaOH=NaAlO2+2H2O,所以n[Al(OH)3]=(0.18L﹣0.16L)×5mol/L=0.1mol,故3×0.1mol+2n[Mg(OH)2]=0.7mol,解得n[Mg(OH)2]=0.2mol,由元素守恒可知n(Mg)=n[Mg(OH)2]=0.2mol,所以Mg的质量为0.2mol×24g/mol=4.8g, 故答案为:4.8g; ②由①计算可知,n(Al)=n[Al(OH)3]=(0.18L﹣0.16L)×5mol/L=0.1mol,故m(Al)=0.1mol×27g/mol=2.7g, 故答案为:2.7; ③加入氢氧化钠溶液为160mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,溶液为氯化钠溶液,根据钠元素守恒此时溶液中n(NaCl)=n(NaOH)=0.16L×5mol/L=0.8mol,根据氯元素守恒n(HCl)=0.8mol,故盐酸的物质的量浓度为 故答案为:8. |
| 点评: | 考查镁铝化合物性质、混合物的计算,以图象题的形式考查,题目难度中等,分析图象各阶段 |


科目:高中化学 来源: 题型:
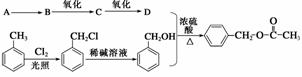
乙酸苯甲酯可提高花或果的芳香气味,常用于化妆品工业和食品工业,下图是乙酸苯甲酯的一种合成路线(部分反应物、产物和反应条件略去)。
请回答:
(1)运用逆合成分析法推断,C的结构简式为
________________________________________________________________________。
(2)
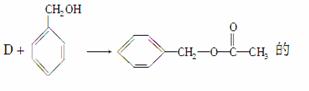
化学方程式为
________________________________________________________________________
________________________________________________________________________。
(3)与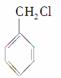 互为同分异构体的芳香化合物有________种,其中一种同分异构体的核磁共振氢谱有三种类型氢原子的吸收峰,该同分异构体的结构简式为________________。
互为同分异构体的芳香化合物有________种,其中一种同分异构体的核磁共振氢谱有三种类型氢原子的吸收峰,该同分异构体的结构简式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在硫酸工业中,通过下列反应使SO2氧化成SO3:
2SO2(g)+O2(g)
 2SO3(g) ΔH=-198 kJ·mol-1。(已知制SO3过程中催化剂是V2O5,它在400℃~500℃时催化效果最好)
2SO3(g) ΔH=-198 kJ·mol-1。(已知制SO3过程中催化剂是V2O5,它在400℃~500℃时催化效果最好)
下表为不同温度和压强下SO2的转化率(%):
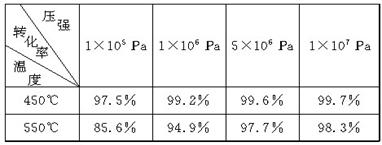
(1)根据化学理论综合分析,为了使二氧化硫尽可能转化为三氧化硫,可控制的条件是________________________________________________________________________。
(2)实际生产中,选定400℃~500℃作为操作温度,其原因是
________________________________________________________________________。
实际生产中,采用的压强为常压,其原因是
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
在生产中,通入过量空气的目的是
________________________________________________________________________
________________________________________________________________________。
(5)尾气中有SO2,必须回收是为了
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应的离子方程式中错误的是()
| A. | 氯化铝溶液中加入过量的氨水Al3++3NH3•H2O=Al(OH)3↓+3NH4+ | |
| B. | 铁片放入过量的稀硝酸中3Fe+8H++2NO3﹣=3Fe2++2NO2↑+4H2O | |
| C. | 将铝片放入过量NaOH溶液中2Al+2OH+2H2O=2AlO2﹣+3H2↑ | |
| D. | 偏铝酸钠与过量盐酸反应AlO2﹣+4H+=Al3++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
将氯化铝溶液和氢氧化钠溶液等体积混合,得到的沉淀物中铝元素的质量与溶液中所含铝元素的质量相等,则原氯化铝溶液和氢氧化钠溶液的物质的量浓度之比可能是()
| A. | 1:3 | B. | 3:2 | C. | 1:4 | D. | 2:7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应中,既属于氧化还原反应同时又属于吸热反应的是
A.Ba(OH)2.8H2O与NH4Cl反应 B.灼热的炭与CO2反应
C.铝与稀盐酸反应 D.H2与O2的燃烧反应
查看答案和解析>>
科目:高中化学 来源: 题型:
反应:L(s)+aG(g) bR(g)达到平衡,温度和压强对该反应的影响如右图所示,图中:压强p1>p2,x轴表示温度,y轴表示平
bR(g)达到平衡,温度和压强对该反应的影响如右图所示,图中:压强p1>p2,x轴表示温度,y轴表示平
衡混合气体中G的体积分数。据此可判断
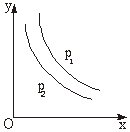 A. 上述反应是放热反应 B. 上述反应是吸热反应
A. 上述反应是放热反应 B. 上述反应是吸热反应
C. a>b D. 无法确定a、b的大小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com