
| A. | AgCl不溶于水,不能转化为AgI | |
| B. | 两种不溶物的Ksp相差越大,不溶物就越容易转化为更难溶的不溶物 | |
| C. | AgI比AgCl更难溶于水,所以,AgCl可以转化为AgI | |
| D. | 常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于$\frac{8.5}{\sqrt{1.8}}$×10-12mol•L-1 |
分析 A.AgCl能转化为AgI;
B.沉淀转化为溶解度更小的物质容易发生;
C.根据沉淀转化原理分析;
D.根据Ksp(AgCl)求出c(Ag+),再利用Ksp(AgI)求出碘离子的浓度.
解答 解:A.AgCl难溶,但是AgI溶解度更小,所以AgCl能转化为AgI,故A错误;
B.两种不溶物的Ksp相差越大,溶解度差别就越大,沉淀转化为溶解度更小的物质容易发生,故B正确;
C.根据沉淀转化原理:溶解度小的能转化为溶解度更小的,所以AgCl可以转化为AgI,故C正确;
D.已知Ksp(AgCl)=1.8×10-10,则c(Ag+)=$\sqrt{Ksp(AgCl)}$=$\sqrt{1.8×1{0}^{-10}}$,c(I-)=$\frac{Ksp(AgI)}{c(A{g}^{+})}$=$\frac{1.0×1{0}^{-16}}{\sqrt{1.8×1{0}^{-10}}}$=$\frac{1}{\sqrt{1.8}}×1{0}^{-11}$mol/L,故D错误;
故选AD.
点评 本题考查难溶电解质的溶解平衡及沉淀转化的本质,注意沉淀转化为溶解度更小的物质容易发生.


科目:高中化学 来源: 题型:解答题
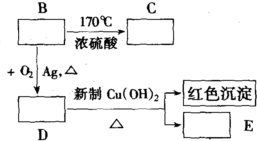
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验内容 | 实验目的 |
| A | 向1mL0.2mol/LNaOH溶液中滴入2滴0.1mol/LMgCl2溶液,产生白色沉淀后,再滴加2滴0.1mol/LFeCl3溶液,又生成红褐色沉淀 | 证明在相同条件下溶解度Mg(OH)2>Fe(OH)3 |
| B | 过量的铁粉中加入稀硝酸,充分反应后,滴入KSCN溶液,溶液不呈红色 | 证明稀硝酸不能将铁氧化为Fe3+ |
| C | 向淀粉水解液中加入新制Cu(OH)2,煮沸,没有生成砖红色沉淀 | 淀粉没有水解 |
| D | 向混有BaCO3沉淀的NaOH溶液中滴入已知浓度的盐酸(用酚酞作指示剂) | 滴定其中NaOH含量 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、NH4+、SO42-、NO3- | B. | H+、K+、HS-、SO42-? | ||
| C. | Fe2+、H+、Cl-、NO3- | D. | Na+、Ba2+、S2-、SO3 2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入H2O(g),平衡向正反应方向移动,体系压强减小 | |
| B. | 加入CO,混合气体的密度增大 | |
| C. | 降低温度,平衡向正反应方向移动 | |
| D. | 加入少量C,正反应速率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 晶体中阳离子和阴离子数不一定相等 | |
| B. | 晶体中一定只有离子键没有共价键 | |
| C. | 所含元素一定不在同一周期也不在第1周期 | |
| D. | 晶体中阳离子半径一定大于阴离子半径 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com