

 ,写出戊的电子式
,写出戊的电子式 ;
; NaHCO3+NaOH;(用化学反应方程式表示)
NaHCO3+NaOH;(用化学反应方程式表示)分析 A为自然界中最硬的单质,应为碳,B可与冷、浓硫酸发生钝化,应为Al,C为淡黄色的固体单质,为S,分析题干信息可知,戊为淡黄色固体与丁气体反应推断为Na2O2,丁为CO2,乙溶液和丙溶液足量反应生成二氧化碳气体,甲、乙、丙分别是3种含氧酸的钠盐.甲、丙溶液pH>7,乙溶液pH<7,甲中含B元素,应为NaAlO2,乙中含S元素,应为NaHSO4,则己为Al2(SO4)3,丙中含C元素,由反应丁+戊→丙可知丙为Na2CO3,生成白色沉淀为Al(OH)3,以此解答该题.
解答 解:A为自然界中最硬的单质,应为碳,B可与冷、浓硫酸发生钝化,应为Al,C为淡黄色的固体单质,为S,分析题干信息可知,戊为淡黄色固体与丁气体反应推断为Na2O2,丁为CO2,乙溶液和丙溶液足量反应生成二氧化碳气体,甲、乙、丙分别是3种含氧酸的钠盐.甲、丙溶液pH>7,乙溶液pH<7,甲中含B元素,应为NaAlO2,乙中含S元素,应为NaHSO4,则己为Al2(SO4)3,丙中含C元素,由反应丁+戊→丙可知丙为Na2CO3,生成白色沉淀为Al(OH)3,
(1)C为S元素,原子核外有3个电子层,最外层电子数为6,原子结构示意图为 ,过氧化钠电子式为
,过氧化钠电子式为 ,
,
故答案为: ;
;  ;
;
(2)乙为NaHSO4,溶液呈酸性,发生电离的方程式为NaHSO4=Na+H++SO42-,丙为Na2CO3,发生,溶液呈碱性Na2CO3+H2O NaHCO3+NaOH,
NaHCO3+NaOH,
故答案为:NaHSO4=Na+H++SO42-;Na2CO3+H2O NaHCO3+NaOH;
NaHCO3+NaOH;
(3)①硫酸氢钠溶液呈酸性,与碳酸钠溶液+反应生成二氧化碳气体,离子方程式为2H++CO32-=CO2↑+H2O,故答案为:2H++CO32-=CO2↑+H2O;
②硫酸铝和碳酸钠溶液发生的互促水解反应,离子方程式为2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑,
故答案为:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑.
点评 本题综合考查了位置、结构与性质关系以及无机物的推断,题目难度中等,正确推断各元素、物质的名称为解答关键,注意掌握常见元素单质及其化合物性质,明确常见化学用语的表示方法,试题培养了学生灵活应用基础知识的能力.


科目:高中化学 来源: 题型:多选题
| A. | Na2CO3和NaOH都能抑制水的电离 | |
| B. | 0.1 mol•L-1Na2CO3溶液加水稀释,CO32-的水解程度增大,溶液pH减小 | |
| C. | 酸碱中和滴定实验中,锥形瓶需用待测液润洗2~3次后,再加入待测液 | |
| D. | 常温下,pH=3的盐酸、醋酸分别用水稀释m倍、n倍后pH相同,则m<n |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
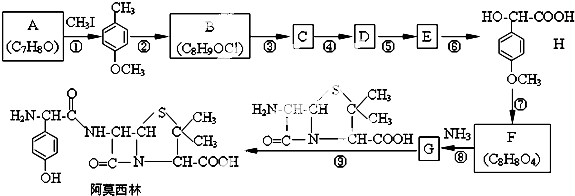
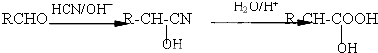
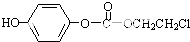 ,该物质在NaOH水溶液中加热反应时的化学方程式为
,该物质在NaOH水溶液中加热反应时的化学方程式为 +5NaOH$→_{△}^{H_{2}O}$
+5NaOH$→_{△}^{H_{2}O}$ +HOCH2CH2OH+Na2CO3+NaCl+2H2O.
+HOCH2CH2OH+Na2CO3+NaCl+2H2O. .
.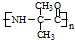 的合成路线流程图(无机试剂任用).
的合成路线流程图(无机试剂任用).查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3,3-二甲基丁烷 | B. | 3-甲基-2-乙基-1-戊烯 | ||
| C. | 3,4-二甲基-3-戊烯 | D. | 2,3-二甲基-1-己炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol•L-1 | B. | $\frac{100ρ}{103.65}$mol•L-1 | ||
| C. | $\frac{ρ}{103.65}$mol•L-1 | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯的结构简式:CH2CH2 | B. | 乙烯的分子式:C2H4 | ||
| C. | 乙酸的结构简式:C2H2O2 | D. | 丙烷分子的球棍模型是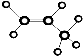 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2和SiO2 | B. | NaCl和HCl | ||
| C. | (NH4)2CO3和CO(NH2)2 (尿素) | D. | NaH和KCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com