
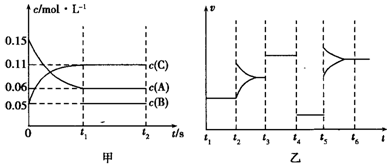
| A. | 若t1=15s,生成物C在t0~t1时间段的化学反应速率为0.004mol•L-1•s-1 | |
| B. | t4~t5阶段改变的条件为降低反应温度 | |
| C. | B的起始物质的量为0.02mol | |
| D. | t5~t6阶段可能是增大压强 |
分析 A.根据v=$\frac{△c}{△t}$计算反应速率;
B.t4~t5阶段正逆反应速率减小且相等,如是降低温度,平衡移动发生移动,则正逆反应速率不相等;
C.根据C、A浓度的变化判断二者计量数关系,根据t4~t5阶段判断化学方程式,根据化学方程式计算;
D.如果增大压强,正逆反应速率都增大,平衡不移动.
解答 解:A、若t1=15s,生成物C在t0~t1时间段的平均反应速率为:v(C)=$\frac{0.11mol/L-0.05mol/L}{15s}$=0.004mol•L-1•s-1,故A正确;
B.如t4~t5阶段改变的条件为降低反应温度,平衡移动发生移动,则正逆反应速率不相等,应为降低压强,故B错误;
C.反应中A的浓度变化为0.15mol/L-0.06mol/L=0.09mol/L,C的浓度变化为0.11mol/L-0.05mol/L=0.06mol/L,反应中A与C的计量数之比为0.09:0.06=3:2,t3~t4阶段与t4~t5阶段正逆反应速率都相等,而t3~t4阶段为使用催化剂,则t4~t5阶段应为减小压强,则该反应中气体的化学计量数之和前后相等,则有:3A(g)?B(g)+2C(g),根据方程式可知消耗0.09mol/L的A,则生成0.03mol/L的B,容器的体积为2L,生成B的物质的量为0.06mol,平衡时B的物质的量为0.1mol,所以起始时B的物质的量为0.1mol-0.06mol=0.04mol,故C错误;
D、由C分析可知,如增大压强,平衡不移动,可知t5~t6阶段应为升高温度,故D错误;
故选A.
点评 本题考查化学平衡移动图象、外界条件对平衡的影响、化学平衡与反应速率计算等,为高考常见题型,侧重考查学生的分析能力,难度中等,注意从乙图判断各阶段的影响因素此为解答该题的关键,结合甲图中各物质的浓度,判断反应条件的改变.


 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | NH4Cl固体和NaCl固体-分别滴加NaOH溶液并加热 | |
| B. | K2SO4固体和Na2SO4固体-焰色反应 | |
| C. | HC1溶液和H2SO4溶液-分别滴加AgNO3溶液 | |
| D. | FeC13溶液和Fe(OH)3胶体一束强光照射 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 构成原电池正极和负极的材料必须是两种金属 | |
| B. | 由Cu、Zn作电极与CuSO4溶液组成的原电池中,Cu是负极 | |
| C. | 铜锌原电池工作时,若有13 g锌被溶解,电路中就有0.4 mol电子通过 | |
| D. | 马口铁(镀锡铁)破损时与电解质溶液接触,锡先被破坏 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
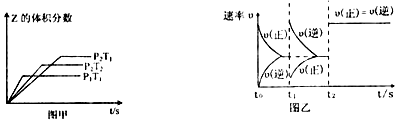
| A. | 图甲,P1>P2,a<3 | |
| B. | 图甲,T1<T2,Q>0 | |
| C. | 图乙,t1时表示恒温、恒压条件下,向平衡体系中充入一定量的Z气体 | |
| D. | 图乙,如果a=3,t2时表示向体系中加入了催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钡可用作“钡餐”,是因为碳酸钡不溶于水 | |
| B. | 雷雨发庄稼是因为雷雨过后空气变得清新 | |
| C. | 聚氯乙烯在食品工业中常用作食品包装袋 | |
| D. | 纯碱可用作锅炉除垢时沉淀硫酸钙的转化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol氯化钠中含有NA个氯化钠分子 | |
| B. | 标准状况下,6g金刚石中含有2NA个碳碳单键 | |
| C. | 在SiO2晶体中,1molSiO2含有2NA个硅氧键 | |
| D. | 在12g石墨片层结构中,含有六元环的个数为0.5NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com