
分析 Ⅰ.(1)在阳离子中,核电荷数=质子数=核外电子数+所带电荷数,中子数=质量数-质子数,据此分析;
(2)元素A的质量数为m,A2-离子的原子核内有x个中子,则A的质子数为m-x,所以A2-中核外电子数为m-x+2,计算出n克A2-离子的物质的量,则可计算电子个数;
Ⅱ.(1)具有相同质子数,不同的中子数的核素互称同位素;
(2)氢原子有三种同位素H、D、T,氧原子有三种同位素168O、178O和188O,依此判断水分子的种数;
Ⅲ.一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,含有离子键的化合物是离子化合物,只含共价键的化合物是共价化合物,据此分析解答.
解答 解:Ⅰ.(1)根据在阳离子中:核电荷数=质子数=核外电子数+所带电荷数,即核电荷数=质子数=x+n,又根据中子数=质量数-质子数=A-(x+n),
故答案为:A-x-n;
(2)元素A的质量数为m,A2-离子的原子核内有x个中子,则A的质子数为m-x,所以A2-中核外电子数为:m-x+2,
n(A2-)=$\frac{n}{m}$mol,则n克A2-离子中包含电子个数是$\frac{n}{m}$molmol×(m-x+2)×NA/mol=$\frac{n}{m}$(m-x+2)mol;
故答案为:$\frac{n}{m}$(m-x+2)mol;
Ⅱ.(1)①${\;}_{8}^{16}$O、${\;}_{8}^{17}$O、${\;}_{8}^{18}$O的质子数相同,中子数不同,故互为同位素;
②H2、D2、T2 是由氢的同位素原子构成的氢分子,既不是同位素,也不是同素异形体;
③石墨、金刚石都是由碳元素形成的不同单质,互为同素异形体;
④${\;}_{1}^{1}$H、${\;}_{1}^{2}$H、${\;}_{1}^{3}$H质子数相同,中子数不同,故互为同位素;
故答案为:①④;
(2)氢原子有三种同位素${\;}_{1}^{1}$H、${\;}_{1}^{2}$H、${\;}_{1}^{3}$H,氧原子有三种同位素${\;}_{8}^{16}$O、${\;}_{8}^{17}$O、${\;}_{8}^{18}$O,水分子是由2个氢原子和1个氧原子构成的,故水分子有2×3×3=18种,
故答案为:18;
Ⅲ.①N2中只含共价键,属于单质;
④CH4 ⑤CO2 ⑦H2S中只含共价键,属于共价化合物;
③NH4Cl ⑧KOH ⑨Na2O2中含有离子键和共价键,属于离子化合物;
②MgCl2 ⑩K2O中只含离子键,属于离子化合物;
⑥Ne中没有化学键;
故答案为:①④⑤⑦;③⑧⑨.
点评 本题考查了原子符号的含义、同位素、物质和化学键的关系,明确物质中存在的化学键是解本题关键,题目难度不大.


 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ①②③ | C. | ③⑤ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第IA族的金属单质与水反应一定比第ⅡA族的金属单质剧烈 | |
| B. | 第二周期元素的最高正价和最低负价的绝对值之和等于8 | |
| C. | 同周期主族元素的原子形成简单离子的电子层结构相同 | |
| D. | 元素原子的最外层电子数的多少与其非金属性的强弱无必然联系 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物中一定含有离子键 | |
| B. | 单质分子中均存在化学键 | |
| C. | 含有金属元素的物质中均存在离子键 | |
| D. | 含有共价键的化合物一定是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 将图1所示装置中的盐桥换成铜导线与两石墨棒连接得到图2所示装置,发现电流计指针仍然有偏转,下列说法不正确的是( )
将图1所示装置中的盐桥换成铜导线与两石墨棒连接得到图2所示装置,发现电流计指针仍然有偏转,下列说法不正确的是( )| A. | 图2中电流计指针偏转方向与图1中相同 | |
| B. | 图2中石墨a上有铜生成 | |
| C. | 向图2中甲装置石墨c附近滴加酚酞试液,出现红色 | |
| D. | 图2中电子流向为Fe→电流计→石墨a→石墨b→铜丝→石墨c→Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 40℃之前与40℃之后溶液变蓝的时间随温度的变化趋势相反 | |
| B. | 图中a点对应的NaHSO3反应速率为5.0×10-5 mol•L-1•s-1 | |
| C. | 图中b、c两点对应的NaHSO3反应速率相等 | |
| D. | 40℃之后,淀粉不宜用作该实验的指示剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
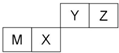
| A. | 离子半径Y<Z<M | |
| B. | Y的最高价氧化物对应水化物的酸性比X的强 | |
| C. | X的最简单气态氢化物的热稳定性比Z的大 | |
| D. | 单质沸点:M>X>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 少用煤作燃料 | B. | 把工厂烟囱造高 | ||
| C. | 燃烧脱硫煤 | D. | 在已酸化的土壤中加石灰 | ||
| E. | 开发新能源 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com