
| A. | NH3的质量分数将增加 | B. | 平衡向正反应方向移动 | ||
| C. | 平衡向逆反应方向移动 | D. | 正逆反应速率都增大 |
分析 若将平衡体系中各物质的浓度都增加到原来的2倍,则应缩小体积,增大压强,则平衡向正反应方向移动,以此来解答.
解答 解:反应前气体化学计量数之和大于反应后气体的化学计量数之和,若将平衡体系中各物质的浓度都增加到原来的2倍,则应缩小体积,增大压强,则平衡向正反应方向移动,
A.平衡正向移动,所以NH3的质量分数将增加,故A正确;
B.由上述分析可知,平衡正向移动,故B正确;
C.平衡正向移动,而不是逆向移动,故C错误;
D.压强增大,正逆反应速率均增大,故D正确;
故选C.
点评 本题考查化学平衡的影响因素,题目难度不大,本题注意浓度、压强对化学平衡的影响,把握浓度的变化转化为压强问题是解答的关键.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
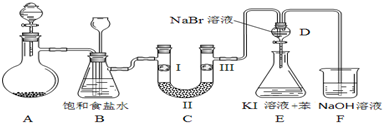
| a | b | c | d | |
| I | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 晶体硅与金刚石分子都是正四面体结构 | |
| B. | 硅酸盐都不溶于水? | |
| C. | 硅与酸、碱都不能发生反应 | |
| D. | 原硅酸和硅酸对应的酸酐都是二氧化硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
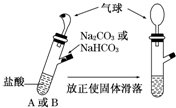
| A. | A装置的气球膨胀速度快 | |
| B. | 若最终两气球体积相同,则盐酸的浓度一定大于或等于2 mol/L | |
| C. | 若最终两气球体积不同,则盐酸的浓度一定小于或等于1 mol/L | |
| D. | 最终两试管中Na+的物质的量一定相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B>C>A>D | B. | A>C>D>B | C. | D>A>C>B | D. | C>D>A>B |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
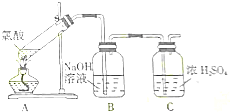
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com