
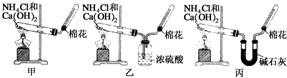
 甲、乙、丙三位同学分别用如下三套实验装置及化学药品(其中碱石灰为固体氢氧化钠和生石灰的混合物)制取氨气.请你参与探究,并回答下列问题:
甲、乙、丙三位同学分别用如下三套实验装置及化学药品(其中碱石灰为固体氢氧化钠和生石灰的混合物)制取氨气.请你参与探究,并回答下列问题:分析 (1)氯化铵与氢氧化钙在加热条件下反应生成氯化钙、氯气和水;
(2)依据氨气极易溶于水,密度小于空气,选择收集方法;
(3)浓硫酸具有吸水性和酸性,能够做干燥剂,但是不能干燥碱性气体;氨气与硫酸反应生成硫酸铵;
(4)氨气为碱性气体,与水反应生成一水合氨,一水合氨电离生成氢氧根离子,显碱性遇到湿润的红色石蕊试纸变蓝色;
(5)碳酸氢铵分解生成氨气、二氧化碳、水,要得到纯净的氨气,应除去二氧化碳和水.
解答 解:(1)氯化铵与氢氧化钙在加热条件下反应生成氯化钙、氯气和水,化学方程式:
2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(2)氨气极易溶于水,所以不能用排水法收集,只能用排气法收集,又因为其密度小于空气密度,所以选择向下排空气法;
故选:BD;
(3)氨气为碱性气体,浓硫酸具有酸性能够与氨气反应生成硫酸铵,方程式:2NH3+H2SO4═(NH4)2SO4,所以不能用浓硫酸干燥氨气,乙同学收集不到氨气;
故答案为:乙 2NH3+H2SO4═(NH4)2SO4;
(4)氨气是碱性气体,遇到遇到湿润的红色石蕊试纸变蓝色,据此可以判断氨气的存在;
故选:C;
(5)碳酸氢铵分解生成氨气、二氧化碳、水,要得到纯净的氨气,应除去二氧化碳和水,甲同学制备的氨气中含有二氧化碳和水蒸气;
乙同学用浓硫酸干燥氨气,氨气被吸收,收集不到氨气;
丙同学,用碱石灰吸收二氧化碳和水蒸气,可以收集到纯净的氨气;
故答案为:丙.
点评 本题考查了氨气的实验室制备,明确制备原理和氨气的性质是解题关键,注意氨气的收集方法的选择,题目难度不大.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:选择题
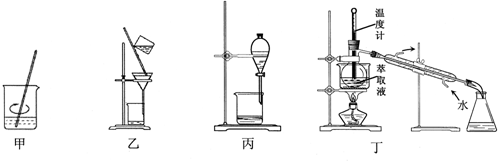
| A. | 用装置甲加稀H2SO4及H2O2氧化并用CCl4浸取 | |
| B. | 用装置乙过滤分离出浸取液 | |
| C. | 用装置丙分离得到碘的四氯化碳溶液 | |
| D. | 用装置丁分离萃取液中单质碘和四氯化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HF的电离常数是① | B. | HNO2的电离常数是① | ||
| C. | HCN的电离常数是② | D. | HNO2的电离常数是③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
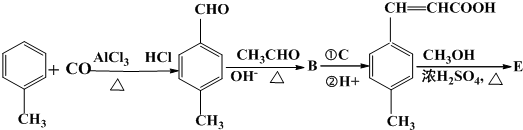
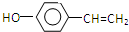 ;
;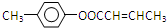 是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为
是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为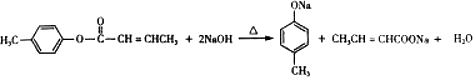 .
.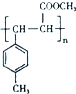 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化性(酸性溶液):FeCl3>Co(OH)3>I2 | B. | 还原性(碱性溶液):Fe(OH)2>I2>KIO3 | ||
| C. | 热稳定性:NaCl>NaClO>NaClO4 | D. | 酸性(水溶液):H2CO3>HSCN>HCN |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com