
ͭ���仯�����������������й㷺Ӧ�ã�ͭ�ڻ������еij������ϼ���+l��+2����֪Cu2O��ϡ���ᷴӦ����Һ����ɫ��
��1����ҵ�Ͽ���Cu2S+O2 2Cu+SO2��Ӧ��ȡ��ͭ������32gCu2S����ʱ������ת����Ŀ�� ��
2Cu+SO2��Ӧ��ȡ��ͭ������32gCu2S����ʱ������ת����Ŀ�� ��
��2��������ͭ˿����������ϡ�����У��¶ȿ�����50�棬����H2O2����Ӧһ��ʱ������µ�60�棬�ٷ�Ӧһ��ʱ�����Ƶ�����ͭ���¶ȿ�����50��-60�������ԭ����˼ӿ췴Ӧ�����⣬���� ����CuSO4��Һ�м���һ������Na2SO3��NaCl��Һ���ȣ�����CuCl����,д������CuCl�����ӷ���ʽ ��
��3��ijС��ͬѧ����ͭ��Ũ���ᷴӦ��ʵ��ʱ������ͭƬ�����к�ɫ�������ɡ�
�ټ�ͬѧ���룺��ɫ������δ���ü��ܽ������CuO, �������û�ѧ����ʽ��ʾΪ��
Cu + H2SO4
����ͬѧ��Ϊ����ɫ�����CuO����ܺ���Cu2S��CuS.�����ɿ����� ������ĸ��
a.Cu2S��CuS���Ǻ�ɫ��
b.ͭ��Ũ�����ڼ��������·�Ӧ�������ܷų�O2
c.Ũ��������������ͭ�ǻ�ԭ����Cu�Ļ��ϼ�������S�Ļ��ϼ��½��ж��ֿ���
��4������Cu��Cu2O��CuO��ɵĻ�����У�����1 L 0.6 mol/L HNO3��Һǡ��ʹ������ܽ⣬ͬʱ�ռ���2240 mL NO���壨��״������Cu2O��ϡ���ᷴӦ�����ӷ���ʽ �����������������������H2���Ȼ�ԭ�����õ����������Ϊ g����������к�0.1 mol Cu�����û������ϡ�����ַ�Ӧ����������H2SO4�����ʵ���Ϊ ��
��1��1.2NA ��1�֣�
��2��ͬʱ��ֹH2O2�ֽ⣨1�֣�
Cu2++2Cl-+SO32-+H2O CuCl��+ SO42-+2H+��2�֣�
CuCl��+ SO42-+2H+��2�֣�
��3����CuO+SO2��+H2O ��1�֣� ��ac��2�֣�
��4��3 Cu2O +14 H+ + 2 NO3- =" 6" Cu2+ + 2 NO�� + 7 H2O ��2�֣�
16��2�֣� 0.1 mol��2�֣�
���������������1�����ϼ����ߵķ�ӦΪ-2�۵�S������+4�ۣ�����32gCu2S��Ӧ����ת����ĿΪ��32g��160g/mol��6NAmol-1=1.2NA ��
��2����ΪH2O2�ڽϸ��¶�ʱ�����ֽ⣬�����¶ȿ�����50��-60�棬���Է�ֹH2O2�ֽ⣻����������ԭԭ����Cu2+��SO32?����ΪSO42?������ԭ���غ㣬��Ӧ���Cu2+��Cl?��SO32?�⣬����H2O�����ﻹ��H+����ƽ�ɵ����ӷ���ʽ��
(3)��Ũ�����ͭ����ΪCuO����������ԭΪSO2��ͬʱ����ˮ��
�ڴ����ʵ���ɫ�жϣ�Cu2S��CuS����ɫҲ�Ǻ�ɫ�ģ���a����ȷ��Cu���ʿɱ�����Ϊ+2�ۻ�+1��ͭ��Ũ�����е�SԪ��Ҳ�ɱ���ԭΪ���ֵͼ�̬����c����ȷ��
��4��ϡ����ɰ�+1��Cu����Ϊ+2��Cu��ͬʱ����ԭΪNO������������ԭ���ɿ�д�����ӷ���ʽ��HNO3������Ϊ0.6mol����Ϊ��������Ӧ��HNO3����ԭΪNO�������ʵ���Ϊ��2.24L��22.L/mol=0.1mol����ô���������õ�HNO3Ϊ��0.6mol-0.1mol=0.5mol���ⲿ��HNO3ת��Ϊ��Cu(NO3)2������Ԫ���غ��֪��ԭ��������CuԪ�ص����ʵ��������������õ�HNO3�����ʵ���֮��Ϊ1:2��H2��ԭ���յõ�CuΪ��0.5mol��2��64g/mol=16g����������к�0.1 mol Cu������������ԭ��Ӧ���ӵ�ʧ������ȿɵã�2��0.1mol+2��n(Cu2O)=3��0.1mol��n(Cu2O)=0.05mol��������Ŀ������ϢCu2O��ϡ���ᷴӦ����Һ����ɫ��˵��������Cu2+�����ӷ���ʽΪ��Cu2O+2H+=Cu2++Cu+H2O, ��0.05mol Cu2O��ȫ��Ӧ��ҪH2SO40.05mol n(CuO)=0.25mol-0.1mol-2��0.05mol=0.05mol��0.05molCuO ��ȫ��Ӧ��ҪH2SO40.05mol�����Թ�����H2SO4�����ʵ���Ϊ0.1mol��
���㣺���⿼�����ת����Ŀ�ļ��㡢��ѧ����ʽ�����ӷ���ʽ����д����Ӧ�����ķ����Լ���ѧ���㡣



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�й�FeSO4��ת����ϵ����ͼ��ʾ(����������ȥ)��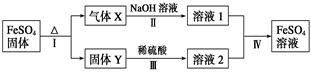
��֪����X�����ֻ�������ɣ���Xͨ��Ʒ����Һ����Һ��ɫ��ͨ��BaCl2��Һ��������ɫ������
��Y�Ǻ���ɫ�Ļ����
��1������X�ijɷ���_______________(�ѧʽ)��д��ͨ��BaCl2��Һ��������ɫ�����Ļ�ѧ����ʽ______________________________��
��2����Ӧ��ķ�Ӧ��������________(�����)��
a���ֽⷴӦ b�����ֽⷴӦ c���û���Ӧ d�����Ϸ�Ӧ e��������ԭ��Ӧ
��3����Һ2�н��������ӵļ��鷽����_____________________________
��4��������Ӧ��õ�16 g����Y������������Xǡ�ñ�0.4 L 1 mol��L��1 NaOH��Һ��ȫ���գ���Ӧ��������FeSO4�����ӷ���ʽ��_________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��������李�(NH4)2Fe(SO4)2���׳�Ī���Σ���ҵ����;�㷺������������ ��
A���� B���� C����
ijͬѧΪ����֤��������茶����е������ӣ����������²�����
��1�������£�����������������茶��������Һ������������Һ��������֧�Թ��У�������һ֧������֤Fe2+��ʵ�飬������±���
| ���� | �����Թ��е��뼸�� ��Һ(�ѧʽ) | �ڼ������뼸��������ˮ |
| ���� | ��Һ�����Ա仯 | ��Һ�Ժ�ɫ |
| ԭ�� | ��Һ��û��Fe3+ | (�ü�Ҫ����˵��ԭ��) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��һ�������¿�ʵ���������ʼ��ת��������ͼ��ʾ��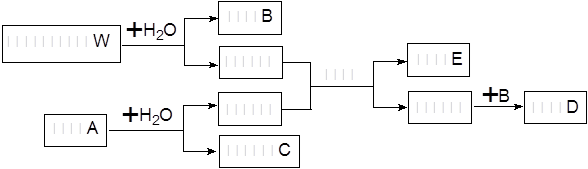
��1������A��һ����Ҫ�Ĺ�ҵԭ�ϣ��仯ѧʽΪ____________________��W�ĵ���ʽΪ_____ ____
��2��д��W���������Ӧ�Ļ�ѧ����ʽ___________________________
��3��������ͼ���й�����ʵ��C��B��ת�䣬д����ת������ӷ���ʽ��__________ _____
��4�������仯�е�B�ͱ������ʵ���3:2��Ӧ�����ӷ���ʽΪ��_______��
��5��������ǡ����ȫ��Ӧ����W��A�����ʵ���֮��Ϊ_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
����һ��Ӧ�ù㷺�Ľ�������ҵ����Al2O3�ͱ���ʯ��Na3AlF6��������ڵ���Ƶá�
�����������Ҫ�ɷ���Al2O3��SiO2�ȡ���������������Al2O3���������£�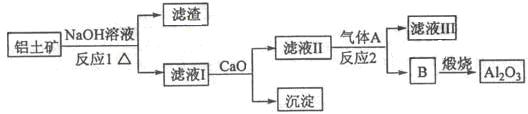
����өʯ��CaF2���ʹ���Ϊԭ���Ʊ�����ʯ���������£�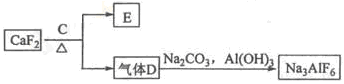
�ش��������⣺
��1��д����Ӧ1�Ļ�ѧ����ʽ ��
��2����Һ���м���CaO���ɵij����� ����Ӧ2�����ӷ���ʽΪ ��
��3��E����Ϊ�������ϣ�������C�� ��д����D�Ʊ�����ʯ�Ļ�ѧ����ʽ ��
��4����������Ļ�ѧ����ʽ�� ����ʯīΪ�缫�����������Ļ������ijɷ��� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
ij��ѧ��ȤС��ģ�ҵ�ϴ���������Ҫ�ɷ���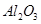 ����
����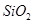 ��
��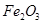 �����ʣ�����ȡ�������Ĺ�����ʵ�飬�������£�
�����ʣ�����ȡ�������Ĺ�����ʵ�飬�������£�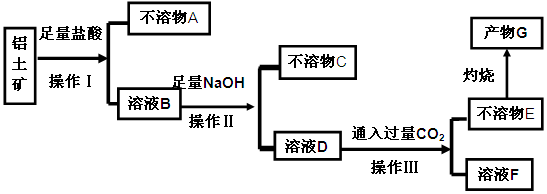
��ش��������⣺
��1�������������Ϊ ��
��2����֤��ҺB���Ƿ���Fe3+�ķ����� ��
��3��������A�� (�ѧʽ)��д��D��E��Ӧ�����ӷ���ʽ ��
��4��˵����ҺF�к�̼Ԫ�����ʵ�һ����; ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��ҵ�Ʊ��Ȼ�ͭʱ����Ũ����������������80 �����ң����������CuO��ĩ(������Fe2O3��FeO)����ֽ��裬ʹ֮�ܽ⣬��һǿ���ԵĻ����Һ�������Ӹû����Һ���Ʊ�������CuCl2��Һ���������²���[�ο����ݣ�pH��9.6ʱ��Fe2����ȫˮ���Fe(OH)2��pH��6.4ʱ��Cu2����ȫˮ���Cu(OH)2��pH��3.7ʱ��Fe3����ȫˮ���Fe(OH)3]����ش��������⣺
��1����һ����ȥFe2�����ܷ�ֱ�ӵ�����ҺpH��9.6����Fe2��������ȥ�� ������ܡ� ���ܡ��������� ��
��2��������ǿ������NaClO�Ƚ�Fe2������ΪFe3�����ٵ�����Һ��PH��Fe3��������ȥ��
�ټ���NaClO����Һ��pH�仯��________(�����)��
A��һ������ B��һ����С C���������� D�����ܼ�С
������Ϊ��NaClO���������Ƿ����� ������ǡ� ���������м��ֳ��õ��������������ڳ�ȥ�����Һ��Fe2������________(�м���ѡ�����������)��
A��ŨHNO3 B��Cl2 C��KMnO4 D��H2O2
��3�������ʵ����ʵ�����ҺpH��ʹFe3+ת��ΪFe(OH)3���������Դﵽ��ȥFe3+������ʧCuCl2��Ŀ�ģ��������ҺpH��ѡ�����������е�___________��
A��NaOH B��NH3��H2O C��CuO D��Cu(OH)2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
ij����С���������Լس�ʯ��K2O?Al2O3?6SiO2��Ϊԭ�ϣ���ȡAl2O3��K2CO3�����ʣ������������£�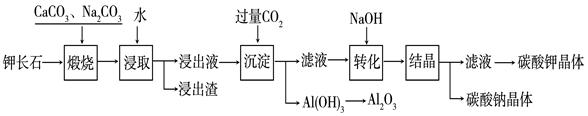
��1�����չ����мس�ʯ�еļ�Ԫ�غ���Ԫ����Na2CO3������ת��Ϊ�����Ե�NaAlO2��KAlO2��д��Al2O3ת��ΪNaAlO2�Ļ�ѧ����ʽ�ǣ� ��
��2����֪NaAlO2��KAlO2��������ˮ�ⷴӦ��AlO2��+ 2H2O  Al(OH)3 + OH�� ������ȡ��ʱӦ������Һ�� �ԣ���ᡱ�����
Al(OH)3 + OH�� ������ȡ��ʱӦ������Һ�� �ԣ���ᡱ�����
��3����ת����ʱ����NaOH����Ҫ������ �������ӷ���ʽ��ʾ����
��4�����������п���ѭ�����õ���Ҫ������ �� ��ˮ��
��5����Al2O3Ϊԭ�ϣ���ʯīΪ�缫��ͨ����ⷨ���Ƶý������������нӵ�Դ������һ���ĵ缫��Ӧʽ�� ����ʱ�������Ҫ�����µ�ʯī�缫���� �������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
�̷�(FeSO4��7H2O)���ᷨ����һ��ϡ�н�����Ʒ�����в����ĸ���Ʒ����Ʒ���Ϊ����ɫ����ɫ�ᾧ���塣���������ɵ��ڼ���ˮ�е�pH����ˮ���������л���ϣ������ٳ�������ҪӦ����ˮ�ʾ�����ҵ��ˮ������ͬʱ����ɱ�����á�
��1��98% 1.84 g/cm3��Ũ������ϡ�����У��ܶ��½�����ϡ����50%ʱ���ܶ�Ϊ1.4g/cm3��50%���������ʵ���Ũ��Ϊ (������λС��)��50%��������30%������������ϣ�������Ũ��Ϊ (��>��<��=")40%" ��
��2��ʵ��������20%��������(100�˷������ẬSO3 20��)����ϡ���ᣬ����SO3��nH2O��ʾ20%�ķ������ᣬ��n=____________(������λС��)��
��3���̷��ڿ��������ױ���������Ϊ����������ȡ7.32�˾�������ϡ�������������BaCl2��Һ�����˵ó���9.32�ˣ���ͨ��112mL(��״��)����ǡ�ý�Fe2����ȫ�������Ʋ⾧��Ļ�ѧʽΪ ��
��4����������泥�(NH4)2SO4��FeSO4��6H2O��(�׳�Ī����)�����̷��ȶ����ڷ�����ѧ�г���������Fe2+�ı���Һ���ô�Fe2+�ı���Һ���Բⶨʣ��ϡ�����������ȡ8.64��Cu2S��CuS�Ļ������200 mL 2 mol/Lϡ������Һ������������Ӧ���£�
10NO3-��3Cu2S��16H��=6Cu2����10NO����3SO42-��8H2O
8NO3-��3CuS��8H��=3Cu2����3 SO42-��8NO��+ 4H2O
ʣ���ϡ����ǡ����V mL 2 mol/L (NH4)2Fe(SO4)2��Һ��ȫ��Ӧ��
��֪��NO3-��3Fe2����4H��= NO����3Fe3+��2H2O
�� Vֵ��Χ ��
�� ��V=48���Լ���������CuS���������� (������λС��)��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com