
锌一空气电池(原理如图)适宜用作城市电动车的动力电源。该电池放电时Zn转化为ZnO。该电池工作时,下列说法正确的是
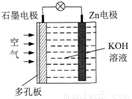
A. Zn电极是该电池的正极
B. Zn电极的电极反应:Zn+H2O-2e-=ZnO+2H+
C. OH-向石墨电极移动
D. 氧气在石墨电极上发生还原反应
科目:高中化学 来源:2016-2017学年湖南省株洲市高一下学期第一次月考化学试卷(解析版) 题型:选择题
科学家预言超级原子的发现将会重建周期表。美国科学家曾在《Science》上发表论文,宣布发现了Al的超级原子Al13和Al14。已知:①Al13、Al14的性质很像现行周期表中的某主族元素,已知这类超级原子具有40个价电子时最稳定(主族元素的价电子就是主族元素原子的最外层电子)。②在质谱仪上检测到稳定的Al13-。下列说法不正确的是
A. Al13与卤素原子性质相似,能形成稳定的Al13-
B. Al14与ⅡA族元素性质相似,容易失去2个电子形成稳定的Al142+
C. Al14与HI反应的化学方程式为Al14+2HI==Al14I2+H2↑
D. 超级原子Al13中铝原子间是通过离子键结合的
查看答案和解析>>
科目:高中化学 来源:2017届辽宁省高三第五次模拟考试理综化学试卷(解析版) 题型:选择题
下列离子方程式书写不正确的是( )
A.AlCl3溶液与烧碱溶液反应,当n(OH-):n(Al3+)=7:2时,2Al3+ + 7OH-=Al(OH)3↓+ AlO2- + 2H2O
B.CuCl2溶液与NaHS溶液反应,当n(CuCl2):n(NaHS)=1:2时Cu2++2HS-=CuS↓+H2S↑
C.Cl2与FeBr2溶液反应,当n(Cl2):n(FeBr2)=1:1时,2Fe2+ + 4Br- +3Cl2=2 Fe3+ + 2Br2 + 6Cl-
D.Fe与稀硝酸反应,当n(Fe):n(HNO3)=1:2时,3 Fe +2NO3- +8H+=3Fe2+ +2NO↑+4H2O
查看答案和解析>>
科目:高中化学 来源:2017届浙江省宁波市高三新高考选考适应性考试化学试卷(解析版) 题型:简答题
向一定质量CaCl2和HCl的混合溶液中逐滴加入浓度为1.000 mol·L-1的Na2CO3溶液,反应过程中加入的Na2CO3溶液的体积与产生沉淀或气体的质量关系如图所示。
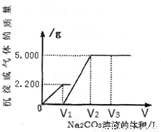
(1)样品中物质的量之比n (CaCl2) :n(HCl)=_____________。
(2)V2=_____________L。
查看答案和解析>>
科目:高中化学 来源:2017届浙江省宁波市高三新高考选考适应性考试化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,下列说法正确的是
A. 足量Mg与2.8gN2完全反应后失去0.2NA电子
B. 3.0g由葡萄糖和冰醋酸组成的混合物中含有的原子总数为0.3NA
C. 常温常压下,2.8gC2H4含有共用电子对的数目为0.6NA
D. 16gO2含有NA个18O原子
查看答案和解析>>
科目:高中化学 来源:2017届浙江省宁波市高三新高考选考适应性考试化学试卷(解析版) 题型:选择题
一定温度下,在2L的密闭容器中发生反应:xA(g)+B(g) 2C(g) △H<0,A、C的物质的量随时间变化的关系如右表所示。下列有关说法正确的是
2C(g) △H<0,A、C的物质的量随时间变化的关系如右表所示。下列有关说法正确的是
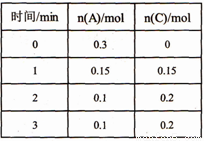
A. x=1
B. 反应开始2min内,用B表示的反应速率为0.05mol · L-l · min -1
C. 反应进行到lmin时,反应体系达到化学平衡状态
D. A的正反应速率等于C的逆反应速率时,反应体系达到化学平衡状态
查看答案和解析>>
科目:高中化学 来源:2017届浙江省宁波市高三新高考选考适应性考试化学试卷(解析版) 题型:选择题
下列物质的水溶液因水解而呈碱性的是
A. NaOH B. NH4Cl C. NaCl D. Na2CO3
查看答案和解析>>
科目:高中化学 来源:2016-2017学年福建省四地六校高二下学期第一次联考(3月)化学试卷(解析版) 题型:
为了探究甲烷和氯气反应的情况,某研究小组设计了几个实验。请填写下列空白:
【实验一】用如图所示装置,用排水法往量筒中先后充入氯气和甲烷气体(各占50%),光照后观察到量筒内有油状液体生成,并形成一段水柱,认为有氯化氢生成。
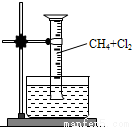
(1)该反应的化学方程式为_________________________;(只写第一步)
(2)水槽中盛放的液体最好为_________________________;(填标号)
A.水 B.饱和石灰水 C.饱和食盐水 D.饱和NaHCO3溶液
【实验二】用排蒸馏水法往量筒中先后充入氯气和甲烷气体(各占50%)收集一试管混合气体,光照反应后,往水槽中滴加AgNO3溶液,看到有白色沉淀生成,认为有氯化氢生成。
(3)该实验设计的不合理之处:___________________________________________________;
【实验三】
步骤一:收集半试管氯气,加入10mL蒸馏水,充分振荡,采用DIS系统的pH传感器测溶液的pH(下同)。测得pH=3.26。
步骤二:收集一试管甲烷和氯气的混合气体(各占50%),在40W的日光灯下光照6min后,加入10mL蒸馏水,充分振荡,测得pH=1.00。
(4)判断该反应中有氯化氢生成的依据是_______________________________________;
(5)假设氯气完全参与反应,且不考虑氯气溶解于水。往反应后的溶液中加水稀释到100.00mL,取20.00mL稀释液,加入10.00mL浓度为0.01mol•L-1的AgNO3溶液恰好完全反应,则试管中原有氯气在标准状况下的体积为____________mL。
查看答案和解析>>
科目:高中化学 来源:2017届山东省济宁市高三第一次模拟(3月)理科综合化学试卷(解析版) 题型:推断题
H是合成抗炎药洛萦洛芬钠的关键中间体,它的一种合成路线如下:

回答下列问题:
(1)G中官能团名称是___________________;反应②的反应类型为________________。
(2)反应①的化学方程式为______________;反应⑥的化学方程式为_____________。
(3)C的结构简式为__________________;E的结构简式为_____________________ 。
(4)写出满足下列条件的F的同分异构体的结构简式:______________________。
Ⅰ.能与FeCl3溶液发生显色反应
Ⅱ.能发生银镜反应
III.核磁共振氢谱有4组峰且峰面积之比为6:2:1:1
(5)仿照H的合成路线,设计一种由 合成
合成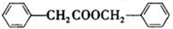 的合成路线_________________________________________________________________________。
的合成路线_________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com