
 ,故答案为:
,故答案为: ;
;

 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案科目:高中化学 来源: 题型:
| 实验 编号 | 反应温度 (利用水浴加热) | 稀硫酸 溶液 | MnSO4固体 | 0.10mol/L KMnO4溶液 | 褪色 时间 |
| 1 | 75℃ | - | - | 1mL | 100s |
| 2 | 75℃ | 10滴 | - | 1mL | 40s |
| 3 | 75℃ | 10滴 | 加入少许 | 1mL | 3s |
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量沉淀于试管中,加入足量,将产生的气体通入 . | |
| 步骤2:向步骤1得到的溶液中滴加几滴. |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定不含Fe3+和Fe2+ |
| B、溶液可能含有AlO2- |
| C、溶液可能含有NO3- |
| D、可能含有Fe3+但一定不含Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、导致易拉罐变瘪的反应是:CO2+2OH-=CO32-+H2O |
| B、导致易拉罐又鼓起来的反应是:2Al+2OH-+2H2O═2AlO2-+3H2↑ |
| C、取易拉罐内反应后的溶液,逐滴加入足量的盐酸,只能发生3个化学反应 |
| D、如果将CO2换为NH3,浓NaOH溶液换为浓盐酸,易拉罐也会出现先瘪后鼓的现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
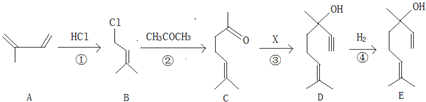
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol的白磷(P4)或四氯化碳(CCl4)中所含的共价键数均为0.4NA |
| B、1L amol/L的氯化铁溶液中,若Fe3+的数目为NA,则Cl-的数目为3NA |
| C、0.1 molN2和0.3molH2在一定条件下充分反应,转移电子数目为0.6NA |
| D、常温常压下,65gZn与足量浓 H2SO4充分反应,转移电子数一定为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、阿司匹林具有解热镇痛作用 |
| B、可以用Si3N4、Al2O3制作高温结构陶瓷制品 |
| C、禁止使用四乙基铅作汽油抗爆震剂,可减少汽车尾气污染 |
| D、在入海口的钢铁闸门上装一定数量的铜块可防止闸门被腐蚀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com