
配制一定物质的量浓度的溶液时,下列做法会使配得的溶液浓度偏高的是( )
A.容量瓶中含有少量蒸馏水
B.将溶液从烧杯转移到容量瓶中后没有洗涤烧杯
C.定容时观察液面俯视
D.定容时倒转容量瓶几次,发现凹液面最低点低于标线,再补几滴水到标线
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
某研究性学习小组设计了一组实验来探究元素周期律。甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成N、C、Si三种非金属元素的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素性质的递变规律。图2中,A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润红纸。已知常温下浓盐酸与高锰酸钾能反应生成氯气。
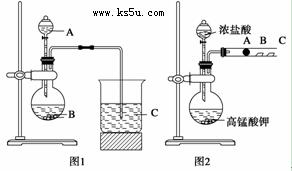
(1)甲同学实验中选用的物质名称为:A____________,B__________,C____________;
(2)C处反应的离子方程式为________________________ 。
(3)写出乙同学的实验中圆底烧瓶中发生反应的化学方程式______________________ ,
(4)A处反应的离子方程式为_________________________;
(5)B处的实验现象为 ___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列除去杂质的方法正确的是 ( )
A.除去乙烷中少量的乙烯:光照条件下通入Cl2,使乙烯转化成液态二氯乙烷而与乙烷分离。
B.除去乙酸乙酯中少量的乙酸:用氢氧化钠溶液洗涤,分液、干燥、蒸馏;
C.除去CO2中少量的SO2:气体通过盛饱和碳酸钠溶液的洗气瓶;
D.除去乙醇中少量的乙酸:加足量生石灰,蒸馏。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列做法存在安全隐患或导致实验失败的是
A.将1mol·L-1FeCl3溶液滴入沸水中制备Fe(OH)3胶体
B.氢气还原氧化铜实验中,先通氢气后加热氧化铜
C.将FeCl3稀溶液加热蒸发浓缩制备FeCl3浓溶液中
D.用烧瓶加热液体时投入碎瓷片以防暴沸
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室里保存下列试剂的方法,有错误的是( )
A.新制氯水盛放在棕色试剂瓶中,存放于低温避光的地方
B.液溴易挥发,盛放在用水液封的棕色试剂瓶中
C.碘易升华,盛放在有水的棕色广口试剂瓶中
D.浓盐酸易挥发,盛装在无色密封的细口玻璃试剂瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验能获得成功的是 ( )
A.将乙醛滴入银氨溶液中,加热煮沸制银镜
B.苯与浓溴水反应制取溴苯
C.向苯酚中加浓溴水观察沉淀
D.1 mol·L-1 CuSO4溶液2 mL和0.5 mol·L-1 NaOH溶液4 mL混合后加入40%的乙醛溶液0.5 mL,加热煮沸观察沉淀的颜色
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关实验的叙述正确的是( )。
A.可用碱式滴定管量取12.85 mL的KMnO4溶液
B.实验室蒸馏石油可用如图甲所示实验装置

C.取用金属钠或钾时,没用完的钠或钾要放回原瓶
D.配制500 mL 0.4 mol·L-1 NaCl溶液,必要的仪器如图乙所示

查看答案和解析>>
科目:高中化学 来源: 题型:
化学是以实验为基础的学科,下列有关实验的描述正确的是
A.向两支分别装有碳酸钠和碳酸氢钠固体的试管中各加几滴水,前者温度降低,后者温度升高
B.向100mL容量瓶中加入4.0gNaOH固体,然后加水到刻度线,配制1.0mol/L的NaOH溶液
C.向酸性重铬酸钾溶液中加NaOH,溶液颜色由橙色慢慢变为黄色
D.如图所示,随着空气的通入,试管内液面会慢慢上升至充满整支试管,而后液面又下降

查看答案和解析>>
科目:高中化学 来源: 题型:
(Ⅰ)甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合来制备甲醇。
已知某些化学键的键能数据如下表:
| 化学键 | C—C | C—H | H—H | C—O | C≡O | H—O |
| 键能/kJ·mol-1 | 348 | 413 | 436 | 358 | 1072 | 463 |
请回答下列问题:
(1)已知CO中的C与O之间为叁键连接,则工业制备甲醇的热化学方程式为
;
(2)某化学研究性学习小组模拟工业合成甲醇的反应,在容积固定为2L的密闭容器内充入1 molCO和 2 molH2,加入合适催化剂(体积可以忽略不计)后在250°C开始反应,并用压力计监测容器内压强的变化如下:
| 反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
| 压强/MPa | 12.6 | 10.8 | 9.5 | 8.7 | 8.4 | 8.4 |
则从反应开始到20min时,以CO表示的平均反应速率= ,该温度下平衡常数K= ,若升高温度则K值 (填“增大”、“减小”或“不变”);
(3)下列描述中能说明上述反应已达平衡的是 ;
A.2 v (H2)正 = v (CH3OH)逆
B.容器内气体的平均摩尔质量保持不变
C.容器中气体的压强保持不变
D.单位时间内生成 n molCO 的同时生成 2n molH2
 (Ⅱ)回答下列问题:
(Ⅱ)回答下列问题:
(1)体积均为100mL pH=2的CH3COOH与一元酸HX,
加水稀释过程中pH与溶液体积的关系如图所示,
则Ka(HX) ______ Ka(CH3COOH)(填>、<或=)
(2)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中C(CH3COO−)-c(Na+)=_________mol·L-1(填精确值)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com