

���� ����ȡ�����еĵ��ʵ�����̿�֪�����������������գ�bΪ����ˮ�ܽ�õ�����Һ������cΪ���ˣ��õ��������ӵ���Һ��d��ͨ���������������ӵõ����ⵥ�ʵ���Һ��eΪ�������Ȼ�̼��ȡ��Һ���õ����ⵥ�ʵ����Ȼ�̼��Һ��ͨ�������ᴿ�õ��ⵥ�ʣ�
��1������a�IJ��������չ��壬��ȥ��ȼ�����ʣ�
��2������b�����ӵ������Ǻ�����ˮ����Ϊ�ӿ��ܽ���������¶ȣ��ò���������ȴ�ʩ��
��3������c�IJ����ǹ��ˣ��ݴ˷�����Ҫ��������
��4������d�з�����Ӧ�������������������ɵⵥ�ʣ�
��5������e�IJ���������ȡ���ڷ�Һ©������ȡ��Һ����ȡ����ѡ��������������������������ȡ���е��ܽ�ȱ���ԭ�ܼ���Ҫ����ȡ����ԭ�ܼ������ܣ���ȡ�������ʲ���Ӧ����Һ�����÷�Һ©�����ձ�������ȡ��Һ��
��6����Cl2+2I-=I2+2Cl-��5Cl2+I2+6H2O��2HIO3+10HCl����϶�����ϵ���㣻
��IO3-+5I-+6H+=3I2+3H2O����Ϸ�Ӧ�Ķ�����ϵ������Ҫ�ĵ⻯�أ�
��� �⣺��1������a�IJ��������չ��壬��ȥ��ȼ�����ʣ��ò�����Ҫ�������н��У��ʴ�Ϊ�����գ���ȥ��ȼ�����ʣ�������
��2������b�ӵ�������ˮ����������Ϊ�ܽ⣬Ϊ�ӿ��ܽ���������¶ȣ��ò���������ȴ�ʩ����ѡAB���ʴ�Ϊ���ܽ⣻AB��
��3������c�IJ����ǹ��ˣ��ò������漰���IJ���������©�����ձ��Ͳ��������ʴ�Ϊ�����ˣ�©�����ձ��Ͳ�������
��4������d�з�����Ӧ�������������������ɵⵥ�ʣ���Ӧ�����ӷ���ʽΪ��Cl2+2I-=2Cl-+I2���ʴ�Ϊ��ͨ�����������������ӣ�Cl2+2I-=2Cl-+I2��
��5������e�IJ�����������ȡ��Һ�����õ���Ҫ�����Ƿ�Һ©�����ձ�����ȡ������߱�����������������ȡ���е��ܽ�ȴ�����ˮ�е��ܽ�ȣ���ȡ����ˮ�����ܣ�����ȡ���͵ⲻ��Ӧ��
A�����Ȼ�̼������ˮ��ˮ�أ�������ȡ���е��ܽ�ȴ�����ˮ�е��ܽ�ȣ���A��ȷ��
B����������ˮ��ˮ�ᣬ������ȡ���е��ܽ�ȴ�����ˮ�е��ܽ�ȣ���B��ȷ��
C���ƾ�������ˮ���ֲܷ㣬��������ȡ������C����
�ʴ�Ϊ����ȡ��Һ����Һ©�����ձ���AB��
��6���ٽ�϶�����ϵ���㣬���ں�2mol���ʵĵ⻯����Һ��ͨ��2mol��������ַ�Ӧ��
Cl2+2I-=I2+2Cl-��
1 2 1
1mol 2mol 1mol
5Cl2+I2+6H2O��2HIO3+10HCl��
5 1 2
1mol 0.2mol 0.4mol
��Ӧ��õ�����Һ�У���I2���ʵ���=1mol-0.2mol=0.8mol��
IO3-���ʵ���=0.4mol��
�ʴ�Ϊ��0.8��0.4��
����ʹ��Ӧ�����Һ�����е�Ԫ�ؾ�ת��Ϊ�ⵥ�ʣ���Ϸ�Ӧ�Ķ�����ϵ������Ҫ�ĵ⻯�أ�
IO3-+5I-+6H+=3I2+3H2O��
1 5
0.4mol 2mol��
Ӧ��Ӧ�����Һ�м���KI����=2mol��166g/mol=332g���ʴ�Ϊ��332��
���� �����Ժ������Ϊ���忼����������ᴿ���ۺ�Ӧ�ã�Ϊ��Ƶ���㣬���������еķ�Ӧ�����������ᴿ����Ϊ���Ĺؼ������ط�������������Ŀ��飬��Ŀ�Ѷ��еȣ�


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 100mL����Һ�к���Na+0.01mol | |
| B�� | 1 L����Һ�к���NaOH40 g | |
| C�� | ��1L����Һ��ȡ��100mL����ȡ����NaOH��Һ��Ũ��Ϊ0.01 mol•L-1 | |
| D�� | ��1Lˮ���ܽ�4g NaOH�������Ƶ�0.1 mol•L-1 NaOH��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Na2O2�������������ǻ�ԭ�� | |
| B�� | Fe2O3�ڷ�Ӧ���������� | |
| C�� | 1molNa2O2������Ӧ����4mol����ת�� | |
| D�� | ��Na2FeO4������ɱ�����������ǿ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 2H++2e-=H2�� | B�� | Fe-3e-=Fe3+ | ||
| C�� | Fe-2e-=Fe2+ | D�� | O2+2H2O+4e-=4OH- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

 ��
��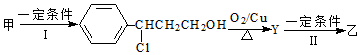
 ����Ʋ�����Ŀ���DZ���̼̼˫������ֹ��������
����Ʋ�����Ŀ���DZ���̼̼˫������ֹ���������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | CO��ȼ����Ϊ 283 kJ | |
| B�� | ��Ӧ������Ӧ������淴Ӧ���֮��Ϊ+566 kJ/mol | |
| C�� | ��Ӧ 2Na2O2��s��+2CO2��s��=2Na2CO3��s��+O2��g����H��-452 kJ/mol | |
| D�� | CO��g���� Na2O2��s����Ӧ�ų� 509 kJ ����ʱ������ת����Ϊ 6.02��1023 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | H-H�������� | |
| B�� | ��̬Cԭ��������δ�ɶԵ��ӣ��������ֻ���γ�2�����ۼ� | |
| C�� | 1��Nԭ�����ֻ����4��Hԭ�ӽ���γ�NH4+�����ɹ��ۼ��ı������������� | |
| D�� | ���е�ԭ�ӹ��������һ������չ����������еĹ��ۼ������з����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
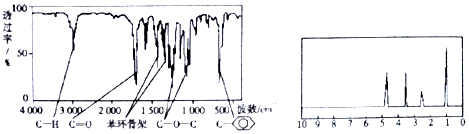
| A�� | A�����������������ӽṹ�к��������ͱ������ֹ����� | |
| B�� | A��һ�������¿���4 mol H2�����ӳɷ�Ӧ | |
| C�� | ��������A���ӽṹ�������л���ֻ��1�� | |
| D�� | ��A����ͬ������ͬ���칹��ֻ��2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢ڢܢ� | B�� | �٢ڢۢ� | C�� | �٢ڢۢ� | D�� | �٢ڢۢܢݢ� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com