
| A. | 合成硫酸的工业尾气可以直接排入大气 | |
| B. | 进入接触室的气体,必须先经净化、干燥 | |
| C. | 从沸腾炉中排出的炉渣可以作为肥料 | |
| D. | 在高温、高压下由SO2和O2合成SO3 |
分析 A.接触法制硫酸所用原料是含硫物质硫铁矿,在沸腾炉中发生反应生成二氧化硫,合成硫酸的工业尾气中含有二氧化硫;
B.接触法制硫酸所用催化剂为V2O5,进入接触室的气体中含有与催化剂反应的气体,导致催化剂失效而中毒;
C.从沸腾炉中发生的反应及产物来分析;
D.利用压强、温度、催化剂、浓度对化学平衡的影响来分析.
解答 解:A.硫铁矿与氧气在沸腾炉中发生反应生成二氧化硫,合成硫酸的工业尾气中含有二氧化硫,二氧化硫是空气污染物,不能直接排入大气,故A错误;
B.接触法制硫酸所用催化剂为V2O5,进入接触室的气体中含有与催化剂反应的气体,导致催化剂失效而中毒,所以进入接触室的气体,必须先经净化、干燥,故B正确;
C.硫铁矿与氧气在沸腾炉中发生反应生成二氧化硫,还有三氧化二铁,所以硫酸工业中沸腾炉排出的矿渣可供炼铁,不是作化肥,故C错误;
D.合成三氧化硫的方程式:2SO2+O2 ?2SO3 △H<0,虽高压有利于化学平衡正向移动,但高压对设备的要求高,增大了生产成本,则工业生产不宜高压,虽高温能加快反应速率,但该反应为放热反应,升高温度化学平衡逆向移动,减小了SO2的转化率,故D错误;
故选B.
点评 本题考查工业制硫酸的知识,题目难度不大,注意工业制备硫酸的原理及设备,还考查化学平衡的影响因素及化学平衡的实际应用,学生应注意理论与实际生产相结合,明确熟悉影响化学平衡移动的常见因素是解答的关键.


科目:高中化学 来源: 题型:选择题
| A. | 澄清石灰水 | B. | 盐酸酸化的Ba(NO3)2溶液 | ||
| C. | BaCl2溶液 | D. | BaCl2与NaOH的混合溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=890.3 kJ•mol-1 | |
| B. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3 kJ•mol-1 | |
| C. | CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| D. | 2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 2:3混合的Fe3O4与FeO | B. | 3:5:4混合的Fe3O4、FeO与Fe | ||
| C. | 4:5混合的Fe2O3和FeO | D. | 1:1:4混合的Fe2O3、Fe3O4与FeO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | X的成分是H2和CO | |
| B. | 阳极的电极反应式为2O2--4e-=O2↑ | |
| C. | 电解质中的O2-移向电极I | |
| D. | 当阴极上有2mol气体生成时,通过电解质的电子数目为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S+O2 $\frac{\underline{\;\;△\;\;}}{\;}$ SO2 | B. | 4FeS2+11O2 $\frac{\underline{\;高温\;}}{\;}$ 2Fe2O3+8SO2 | ||
| C. | 2SO2+O2 $?_{加热}^{催化剂}$ 2SO3 | D. | SO3+H2O=H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
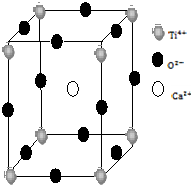 金属Ti性能优越,被誉为继Fe、Al后广泛应用的“第三金属”.
金属Ti性能优越,被誉为继Fe、Al后广泛应用的“第三金属”.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
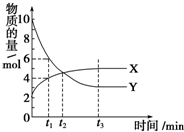 一定温度下在2L密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图.下列叙述中正确的是( )
一定温度下在2L密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图.下列叙述中正确的是( )| A. | 反应的化学方程式为3X(g)?7Y(g) | |
| B. | t1时,Y的浓度是X浓度的1.5倍 | |
| C. | t2时,正、逆反应速率相等 | |
| D. | 0到t1时间段内,Y的平均反应速率为4/t1 mol•L-1•min-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com