
| A.碳原子的杂化类型发生了改变 |
| B.微粒的形状发生了改变 |
| C.微粒的稳定性发生了改变 |
| D.微粒中的键角发生了改变 |
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 实验事实 | 理论解释 |
| A | 氮原子的第一电离能大于氧原子 | 氮原子2p能级半充满 |
| B | CO2为直线形分子 | CO2分子中C—O是极性键 |
| C | 金刚石的熔点低于石墨 | 金刚石是分子晶体,石墨是原子晶体 |
| D | HF的沸点高于HCl | HF的相对分子质量小于HCl |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.在100 ℃、101 kPa条件下,液态水的气化热为40.69 kJ·mol-1,则H2O(g) H2O(l) 的 ΔH =" —40.69" kJ·mol-1 H2O(l) 的 ΔH =" —40.69" kJ·mol-1 |
| B.在25℃、101kPa,2mol S的燃烧热是1mol S的燃烧热2倍 |
| C.CH4(g) +2O2(g) =CO2(g) +2H2O(g) ΔH=-akJ·mol-1,这里ΔH代表燃烧热 |
| D.已知: |
| 共价键 | C-C | C=C | C-H | H-H |
| 键能/ kJ·mol-1 | 348 | 610 | 413 | 436 |
 的ΔH为-384 kJ·mol-1
的ΔH为-384 kJ·mol-1查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.丙烯分子有7个δ键,1个∏键 |
| B.丙烯分子存在非极性键 |
| C.丙烯分子中3个碳原子都是sp3杂化 |
| D.丙烯分子中3个碳原子在同一直线上 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.离子化合物中都含有离子键 |
| B.离子化合物中的阳离子只能是金属离子 |
| C.离子化合物如能溶于水,其水溶液一定可以导电 |
| D.溶于水可以导电的化合物一定是离子化合物 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Zn(s)+CuSO4(aq)=ZnSO4(aq)+Cu(s)ΔH=-216 kJ/mol,则反应物总能量大于生成物总能量 |
| B.若一定条件下,A=B ΔH<0,说明A物质比B物质稳定 |
| C.101 kPa时,2H2(g)+O2(g)=2H2O(l)ΔH=-571.6 kJ/mol,则H2的燃烧热为571.6 kJ/mol |
| D.H+(aq)+OH-(aq)=H2O(l)ΔH=-57.3 kJ/mol,含1 mol NaOH的溶液与含0.5 mol H2SO4的浓硫酸混合后放出57.3 kJ的热量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.只含极性键的共价化合物 |
| B.含非极性键的共价化合物 |
| C.阴阳离子个数之比为1∶1的离子化合物 |
| D.可形成双核离子或者四核离子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CO(g)+H2(g);C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
CO(g)+H2(g);C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为: O2(g)=H2O(g) ΔH=-242.0 kJ·mol-1
O2(g)=H2O(g) ΔH=-242.0 kJ·mol-1 O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1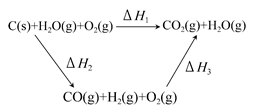
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com