
| A、物质失去电子数越多,物质的还原性越强 |
| B、导电的不一定是电解质,电解质不一定导电 |
| C、得到电子的物质是还原剂 |
| D、还原剂反应后得到是还原产物 |


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案科目:高中化学 来源: 题型:
| A、选择毒性、刺激性较小的染发剂,如植物性染发剂,减少染发剂对人体的伤害 |
| B、染发时应严格遵守染发剂使用说明,不要混合使用不同的染发剂 |
| C、尽量少染发,当头皮有伤口时不要染发 |
| D、染完头发后,不必清洗多次,以免影响染发效果 |
查看答案和解析>>
科目:高中化学 来源: 题型:
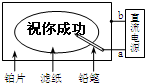 某学生设计了一个“黑笔写红字”的趣味实验.滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹.据此,下列叙述正确的是( )
某学生设计了一个“黑笔写红字”的趣味实验.滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹.据此,下列叙述正确的是( )| A、a点是负极,b点是正极 |
| B、铂片一端发生还原反应 |
| C、铅笔端有少量的氯气产生 |
| D、铅笔端作阳极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
12 6 |
13 6 |

查看答案和解析>>
科目:高中化学 来源: 题型:
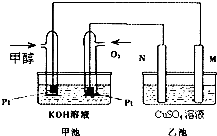 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇和水,并开发出直接以甲醇为燃料的燃料电池.如图中甲池是一个甲醇燃料电池工作时的示意图.乙池中的两个电极均为石墨电极,乙池中盛有100mL 3.00mol.L-1的CuSO4溶液.已知H2(g)、CO(g)和CH3OH(l)的热值分别为143kJ?g-1、10kJ?g-1和23kJ?g-1.请回答下列问题:
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇和水,并开发出直接以甲醇为燃料的燃料电池.如图中甲池是一个甲醇燃料电池工作时的示意图.乙池中的两个电极均为石墨电极,乙池中盛有100mL 3.00mol.L-1的CuSO4溶液.已知H2(g)、CO(g)和CH3OH(l)的热值分别为143kJ?g-1、10kJ?g-1和23kJ?g-1.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| O | - 3 |
| O | - 3 |
| O | - 3 |
| O | - 3 |
| O | - 3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com