
| Cu |
| △ |
| Cu |
| △ |
| FeBr3 |
| FeBr3 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、HA水溶液中微粒浓度大小顺序:c(HA)>c(H+)>c(A-)>c(OH-) |
| B、HA与NH3作用生成的化合物是共价化合物 |
| C、NaA水溶液中:c(Na+)=c(A-)+c(HA) |
| D、稀释0.1mol/LHA水溶液,其电离程度增大,pH也增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,0.1mol?L-1 CH3COOH溶液的pH=1 |
| B、铅蓄电池在放电过程中,负极质量增加,正极pH减少 |
| C、反应CO2(g)+C(s)═2CO(g)在低温下不能自发进行,则其△H>0 |
| D、常温下,向AgCl浊液中加入少量NaCl饱和溶液,则c(Ag+)、Ksp(AgCl)均减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
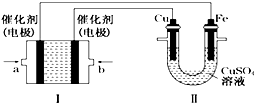 甲烷作为一种新能源在化学领域应用广泛,请回答下列问题:
甲烷作为一种新能源在化学领域应用广泛,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
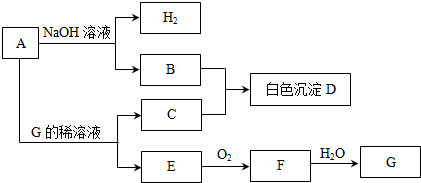
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
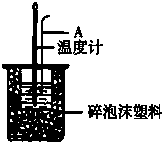 分别取40mL的0.50mol/L盐酸与40mL 0.55mol/L氢氧化钠溶液进行中和反应.通过测定反应过程中所放出的热量可计算中和热.请回答下列问题.
分别取40mL的0.50mol/L盐酸与40mL 0.55mol/L氢氧化钠溶液进行中和反应.通过测定反应过程中所放出的热量可计算中和热.请回答下列问题.| 实验序号 | 起始温度t1℃ | 终止温度t2℃ | |
| 盐酸 | 氢氧化钠 | 混合溶液 | |
| 1 | 20.0 | 20.1 | 23.2 |
| 2 | 20.2 | 20.4 | 23.4 |
| 3 | 20.5 | 20.6 | 23.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、从海水中可以得到NaCl,电解熔融NaCl 可制备Cl2和Na |
| B、海水蒸发制海盐的过程中只发生了化学变化 |
| C、海水中含有钾元素,只需经过物理变化就可以得到钾单质 |
| D、利用潮汐发电是将化学能转化为电能 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com