
 .
.分析 A、X、Y、Z和W是原子序数依次增大的五种短周期元素,A和X可组成两种常温下为液态的化合物A2X、A2X2,应是H2O、H2O2,则A为H、X为O;
X和Y也可组成两种常温下为固体的化合物Y2X、Y2X2,且Y2X、Y2X2的焰色反应均为黄色,含有Na元素,则Y为Na;
在元素周期表中,X与Z相邻,Z与W相邻,结合原子序数可知,Z、W处于第三周期,由位置关系可推知X、Z应同主族,故Z为S、W为Cl,以此来解答.
解答 解:由上述分析可知,A为H,X为O,Y为Na,Z为S,W为Cl,
(1)A2X2为H2O2,分子中O原子之间形成1对共用电子对,O原子与H原子之间形成1对共用电子对,故其结构式为H-O-O-H,Y2X2为Na2O2,由钠离子与过氧根离子构成,过氧根离子中氧原子之间形成1对共用电子对,且氧原子满足8电子结构,其电子式为 ,
,
故答案为:H-O-O-H; ;
;
(2)X、Z两种元素的氢化物分别为H2O、H2S,H2S分子之间存在范德华力,H2O分子之间存在氢键,氢键比范德华力作用更强,故H2O的熔沸点较高;
Z为S元素,Z的低价氧化物为二氧化硫,其高价氧化物为三氧化硫,反应的化学方程式为2SO2+O2$?_{△}^{催化剂}$2SO3,
故答案为:H2O;2SO2+O2$?_{△}^{催化剂}$2SO3;
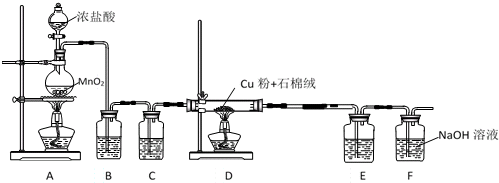
(3)W为Cl元素,实验室通常用二氧化锰与浓盐酸在加热条件下制备氯气,反应化学反应方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
HCl中有$\frac{1}{2}$作还原剂,二氧化锰作氧化剂,由反应及原子守恒可知该反应中氧化剂与还原剂的物质的量之比是1:2,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;1:2.
点评 本题考查原子结构与元素周期律,为高频考点,把握元素化合物知识、元素的位置来推断元素为解答的关键,侧重分析与应用能力的考查,注意化学用语的使用,题目难度不大.


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
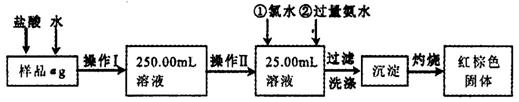
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ,所含化学键类型为共价键.
,所含化学键类型为共价键.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
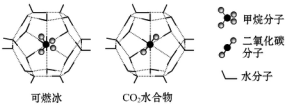 科学家正在研究温室气体CH4和CO2的转化和利用.
科学家正在研究温室气体CH4和CO2的转化和利用.| 参数 分子 | 分子直径/nm | 分子与H2O的 结合能E/kJ•mol-1 |
| CH4 | 0.436 | 16.40 |
| CO2 | 0.512 | 29.91 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
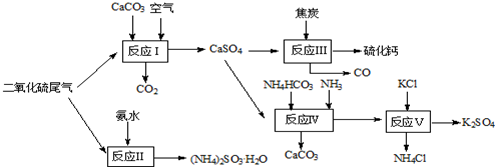
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图所示,甲、乙之间的隔板K和活塞F都可左右移动,甲中充入2molA和1molB,乙中充入2molC和1molHe,此时K停在0处.在一定条件下发生可逆反应:2A(g)+B(g)?2C(g); 反应达到平衡后,再恢复至原温度.回答下列问题:
如图所示,甲、乙之间的隔板K和活塞F都可左右移动,甲中充入2molA和1molB,乙中充入2molC和1molHe,此时K停在0处.在一定条件下发生可逆反应:2A(g)+B(g)?2C(g); 反应达到平衡后,再恢复至原温度.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com