
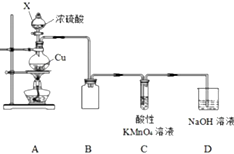
 某化学兴趣小组探究铜与浓硫酸的反应,探究过程如下.
某化学兴趣小组探究铜与浓硫酸的反应,探究过程如下.| 实验步骤 | 现象 | 结论 |
| 取灰色固体于烧杯中,加入蒸馏水,搅拌、过滤,洗涤滤渣 | 固体部分溶解,溶液呈蓝色 | 灰色固体中含有CuSO4 |
| 将滤渣转移到另一烧杯中,加入足量稀硫酸,搅拌,充分反应后过滤,将滤渣洗涤、干燥 | 固体部分溶解,滤液呈蓝色,滤渣为黑色 | 灰色固体中含有CuO |
| 称量上一步得到的黑色滤渣2.56g,在空气中灼烧至恒重,冷却、称量 | 得到2.40g固体 | 灰色固体中含有Cu2S、CuS |
分析 (1)根据仪器X的特征及常见仪器的名称解答;短管进短管出可防止倒吸;
(2)装置气密性检验的原理是:通过气体发生器与附设的液体构成封闭体系,依据改变体系内压强时产生的现象(如气泡的生成、水柱的形成、液面的升降等)来判断装置气密性的好坏;
(3)SO2使酸性高锰酸钾褪色,发生氧化还原反应生成锰离子、硫酸根离子和水;
(4)依据资料有关信息结合铜离子在溶液中呈蓝色分析,得到2.40g固体,根据铜原子守恒分析.
解答 解:A装置中是铜和浓硫酸加热,反应生成硫酸铜、二氧化硫和水,反应的化学方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,B防止倒吸,C利用二氧化硫的还原性检验二氧化硫,D吸收尾气.
(1)X为球形漏斗带有玻璃活塞为分液漏斗,装置B短管进短管出可防止倒吸,
故答案为:分液漏斗;防止倒吸;
(2)装置气密性的检查一般常用加热法,依据的原理是:通过加热(用酒精灯或热毛巾或体温)密闭容器,使其中的气体受热膨胀,压强变大,导致放入水中的导管口有气泡冒出(导管应先放入水中),移开热源后,由于装置中的气体遇冷收缩、压强变小,又会在导管里形成一段水柱,所以组装好仪器,检查装置气密性的操作是手握烧瓶,若C、D导管中有气泡冒出,松开手,C、D中有液柱回流,
故答案为:手握烧瓶,若C、D导管中有气泡冒出,松开手,C、D中有液柱回流;
(3)装置C中SO2和酸性高锰酸钾发生氧化还原反应褪色,生成锰离子、硫酸根离子,离子反应为:2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+,
故答案为:2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+;
(4)铜与浓硫酸反应Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,取灰色固体于烧杯中,加入蒸馏水,搅拌、过滤,洗涤滤渣,固体部分溶解,溶液呈蓝色,为CuSO4,将滤渣转移到另一烧杯中,加入足量稀硫酸,搅拌,充分反应后过滤,将滤渣洗涤、干燥,Cu2S和CuS不溶于稀硫酸,滤液呈蓝色,溶解的是CuO,称量上一步得到的黑色滤渣2.56g,在空气中灼烧至恒重,冷却、称量得到2.40g固体为氧化铜,物质的量为n=$\frac{m}{M}$=$\frac{2.4g}{80g/mol}$=0.03mol,若黑色滤渣为Cu2S则其质量为0.03×$\frac{1}{2}$×160g=2.4g,若黑色滤渣为CuS则其质量为0.03×96g=2.88g,原黑色滤渣为2.56g,为Cu2S、CuS混合物,
故答案为:CuSO4;CuO;Cu2S、CuS.
点评 本题考查了探究铜与浓硫酸的反应,题目难度中等,涉及浓硫酸与铜反应、二氧化硫的还原性的实验验证、污染气体的实验处理、产物的检验等知识,(4)为难点,充分考查了学生的分析、理解能力及灵活应用基础知识的能力.


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 反应①中电能转化为化学能 | |
| B. | 反应②为放热反应 | |
| C. | 反应③使用催化剂,△H3减小 | |
| D. | 反应CH4(g)═C(s)+2 H2(g)的△H=74.8kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯与浓溴水反应制取溴苯 | |
| B. | 将乙醛滴入银氨溶液中,加热煮沸制银镜 | |
| C. | 1 mol•L-1 CuSO4溶液2mL和0.5 mol•L-1 NaOH溶液4 mL混合后加入40%的乙醛溶液0.5 mL,加热煮沸观察沉淀的颜色 | |
| D. | 向稀苯酚中加浓溴水观察沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中,Na+、H+、Cl-、Mg2+可以大量共存 | |
| B. | 与KSCN溶液反应产生红色沉淀 | |
| C. | 加入铜粉,反应的离子方程式为:Cu+Fe3+=Cu2++Fe2+ | |
| D. | 向该溶液中滴入少量Na2S溶液,反应的离子方程式为:2Fe3++3S2-+6H2O=3H2S↑+2Fe(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1014-a-2b | B. | 10a+b-14 | C. | 10a-2b | D. | 10a-2b+14 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com