
亚氨基锂(Li2NH)是一种储氢容量高、安全性好的固体储氢材料,其储氢原理可表示为:
Li2NH+H2===LiNH2+LiH。下列有关说法正确的是( )
A.Li2NH中N的化合价是-1
B.该反应中H2既是氧化剂又是还原剂
C.Li+和H-的离子半径相等
D.此法储氢和钢瓶储氢的原理相同
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体VL(标准状况),向反应后的溶液中(存在Cu2+和SO42-)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO12.0g,若上述气体为NO和NO2的混合物,且体积比为1﹕1,则V可能为( )
A.9.0L B.1 3.5L C.15.7L D.16.8L
3.5L C.15.7L D.16.8L
查看答案和解析>>
科目:高中化学 来源: 题型:
运用化学反应原理研究元素及其化合物的反应有重要意义。
(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+ O2(g) 2SO3(g),混合体系中SO3的百分含量和温度的关系如右图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
2SO3(g),混合体系中SO3的百分含量和温度的关系如右图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:

①2SO2(g) + O2(g) 2SO3(g)的△H____0(填“>”、“<”)。若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡 移动(填“向左”“向右”或“不移动”) 。
2SO3(g)的△H____0(填“>”、“<”)。若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡 移动(填“向左”“向右”或“不移动”) 。
②若温度为T1时,反应进行到状态D时,V正_______V逆(填“>”“<”或“=”)
(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产中有重要作用。
① 右图是一定的温度和压强下N2和H2反应生成lmolNH3过程中能量变化示意图,请写出工业合成氨的热化学方程式:(△H用含字母Q1、Q2的代数式表示) 。

②在AlCl3溶液中滴加氨水,反应的离子方程式为: 。
(3)海水中含有大量的元素,常量元素如氯、微量元素如碘在海水中均以化合态存在。在25℃下,向0.1mol•L-1的NaCl溶液中逐滴加入适量的0.1mol•L-1硝酸银溶液,有白色沉淀生成,向反应后的浊液中,继续加入0.1mol•L-1的NaI溶液,看到的现象是 全品教学网, 用后离不了!,产生该现象的原因是(用离子方程式表示): 。
全品教学网, 用后离不了!(已知25℃时Ksp[AgCl] =1.0×10-10 mol2•L-2,Ksp[AgI] =1.5×10-16mol2•L-2 )
查看答案和解析>>
科目:高中化学 来源: 题型:
铬铁矿的主要成分可表示为FeO·Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以下是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的流程图:

根据题意回答下列问题:
(1)操作Ⅰ的名称是 ,固体X中主要含有 (填写化学式);
(2)用醋酸调节溶液pH=7~8后再进行操作Ⅱ所得固体Y的成分为 (写化学式).
(3)酸化步骤中调节溶液pH<5时发生反应2CrO42-+2H+  Cr2O72-+H2O.若将将醋酸改用盐酸,盐酸会与Cr2O72-反应造成大气污染并生成Cr3+杂质,该反应的离子方程式为 .
Cr2O72-+H2O.若将将醋酸改用盐酸,盐酸会与Cr2O72-反应造成大气污染并生成Cr3+杂质,该反应的离子方程式为 .
(4)下表是相关物质的溶解度数据,操作III发生反应的化学方程式是
Na2Cr2O7+2KCl=K2Cr2O7↓+2NaCl。该反应在溶液中能发生的理由是: 。

(5)含铬废渣(废水)的随意排放对人类生存环境有极大的危害。电解法是处理铬污染的一种方法,金属铁作阳极、石墨作阴极电解含Cr2O72-的酸性废水,一段时间后产生Fe(OH)3和Cr(OH)3沉淀。
 ①电解法处理废水的总反应如下,配平并填写空缺:(已知产物中n(Fe(OH)3): n (H2)=1:1)
①电解法处理废水的总反应如下,配平并填写空缺:(已知产物中n(Fe(OH)3): n (H2)=1:1)
___Fe+___Cr2O72-+___ +___H2O =___Fe(OH)3↓+___Cr(OH)3↓+___H2↑;
②已知常温下Cr(OH)3的Ksp=6.4×10–32mol4/l4,若Ⅰ类生活饮用水水质标准铬含量最高限值是0.052 mg/L,要使溶液中c(Cr3+)降到符合饮用水水质标准,须调节溶液的pH大于______。
(已知lg2=0.3)
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学按如图所示的装置进行电解实验。下列说法不正确的是
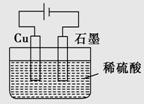
A.电解过程中,铜电极上有H2产生
B.电解初期,总反应方程式为Cu+H2SO4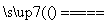 CuSO4+H2↑
CuSO4+H2↑
C.电解一定时间后,石墨电极上有铜析出
D.整个电解过程中,溶液pH值会增大
查看答案和解析>>
科目:高中化学 来源: 题型:
含氮废水进入水体中对环境选成的污染越来越严重。某校环保小组的同学认为可以用金属铝将水中的NO3-还原成N2,从而消除污染。
(1) 配平以下有关的离子反应方程式:

(2)以上反应中失电子的物质是________,还原产物是________,每生成1 mol这种还原产物,将有________电子发生转移。
(3)现需除去1  m3含氮0.3 mol的废水中的NO3-(设氮元素都以NO3-的形式存在),则至少需要消耗金属铝________。
m3含氮0.3 mol的废水中的NO3-(设氮元素都以NO3-的形式存在),则至少需要消耗金属铝________。
(4)你对以上治理污染的方案有何评价?
查看答案和解析>>
科目:高中化学 来源: 题型:
汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3→K2O+5Na2O+16N2↑。若氧化产物比还原产物多1.75mol,则下列判断正确的是
A.生成42.0LN2(标准状况)
B.有0.250molKNO3被氧化
C.转移电子的物质的量为1.25mol
D.被氧化的N原子的物质的量为3.75mol
查看答案和解析>>
科目:高中化学 来源: 题型:
Al、Fe、Cu都是重要的金属元素。下列说法正确的是 ( )
A.三者对应的氧化物均为碱性氧化物
B.三者的单质放置 在空气中均只生成氧化物
在空气中均只生成氧化物
C.制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法
D.电解AlCl3、FeCl3、CuCl2的混合溶液时阴极上依次析出Cu、Fe、Al
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com