
| FeSO4•7H2O | (NH4)2SO4 | FeSO4•(NH4)2SO4•6H2O | |
| 20℃ | 48 | 75 | 37 |
| 60℃ | 101 | 88 | 38 |
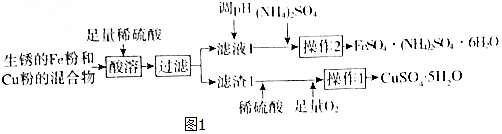
分析 流程分析可知生锈的Fe粉和Cu粉的混合物,加入足量和稀硫酸得硫酸亚铁溶液及铜固体,过滤得滤渣1为铜,滤液1为硫酸亚铁和稀硫酸混合溶液,在铜中再加硫酸同时通入氧气氧化铜得硫酸铜溶液,经蒸浓缩、降温结晶可得硫酸晶体,滤液1经调节PH值,再加入硫酸铵,经蒸发浓缩,趁热过滤可得FeSO4•(NH4)2SO4•6H2O晶体,同时可减小硫酸亚铁和硫酸铵的析出使得FeSO4•(NH4)2SO4•6H2O晶体更纯,再经适量稀硫酸洗涤干燥得较纯的FeSO4•(NH4)2SO4•6H2O晶体,据此答题;
解答 解:流程分析可知生锈的Fe粉和Cu粉的混合物,加入足量和稀硫酸得硫酸亚铁溶液及铜固体,过滤得滤渣1为铜,滤液1为硫酸亚铁和稀硫酸混合溶液,在铜中再加硫酸同时通入氧气氧化铜得硫酸铜溶液,经蒸浓缩、降温结晶可得硫酸晶体,滤液1经调节PH值,再加入硫酸铵,经蒸发浓缩,趁热过滤可得FeSO4•(NH4)2SO4•6H2O晶体,同时可减小硫酸亚铁和硫酸铵的析出使得FeSO4•(NH4)2SO4•6H2O晶体更纯,再经适量稀硫酸洗涤干燥得较纯的FeSO4•(NH4)2SO4•6H2O晶体,
(1)过滤所用的主要玻璃仪器为玻璃棒、漏斗、烧杯,
故答案为:;
(2)根据上面分析可知,溶液1中的主要溶质为FeSO4、H2SO4,
故答案为:FeSO4、H2SO4;
(3)根据题中提供的溶解度数据可知,进行操作2时,从溶液中析出晶体后,需趁热过滤,原因为减小硫酸亚铁和硫酸铵的析出使得FeSO4•(NH4)2SO4•6H2O晶体更纯,
故答案为:减小硫酸亚铁和硫酸铵的析出使得FeSO4•(NH4)2SO4•6H2O晶体更纯;
(4)FeSO4•(NH4)2SO4•6H2O用适量稀硫酸洗涤,抑制亚铁离子和铵根离子的水解,防止亚铁离子被氧化,
故答案为:抑制亚铁离子和铵根离子的水解,防止亚铁离子被氧化;
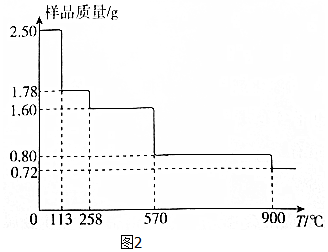
(5)①设 CuSO4•5H2O分解的方程式为CuSO4•5H2O$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4•(5-x)H2O+xH2O,
250 18x
2.5 2.5-1.78
解得x=4,对应固体的化学式为CuSO4•H2O,同理可推知,1.60g对应固体的化学式为CuSO4,所以发生反应的化学方程式为CuSO4•H2O$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+H2O,
故答案为:CuSO4•H2O$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+H2O;
②2.50gCuSO4•5H2O样品中铜元素的物质的量为0.01mol,根据铜元素守恒可知,900℃时剩余固体只有一种铜的氧化物中铜元素也为0.01mol,而此时固体的质量为0.72g,所以氧化物中氧元素的物质的量为$\frac{0.72-0.01×64}{16}$mol=0.005mol,所以该铜的氧化物的化学式为 Cu2O,
故答案:Cu2O.
点评 本题考查了CuSO4•5H2O和FeSO4•(NH4)2SO4•6H2O的制取,涉及的知识点比较多,可以根据信息及所学知识,合理分析得出正确结论,本题难度中等


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2的转化率为60% | |
| B. | SO3的产率为60% | |
| C. | 平衡时总压强与起始压强之比为7:8 | |
| D. | 平衡时V(SO2):V(O2):V(SO3)=3:3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水晶项链和餐桌上的瓷盘都是硅酸盐材料 | |
| B. | 用于制作灯饰外壳材料的聚苯乙烯塑料属于有机高分子材料 | |
| C. | 氮化硅结构陶瓷可以用来做发动机的部件 | |
| D. | 高吸水性材料、光敏性材料等属于功能高分子材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.57 mol | B. | 2.25mol | C. | 2 mol | D. | 0.63mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入大量O2 | B. | 增大容器容积 | C. | 移去部分SO3 | D. | 降低体系温度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com