
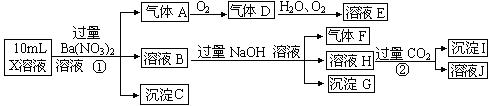
分析 在强酸性溶液中一定不会存在CO32-和SO32-离子,加入过量硝酸钡生成沉淀,则该沉淀为BaSO4沉淀,说明溶液中含有SO42-离子,生成气体A,A连续氧化生成D和E,则A为NO,D为NO2,E为HNO3,说明溶液中含有还原性离子,一定为Fe2+离子,溶液B中加入过量NaOH溶液,生成气体F,则F为NH3,说明溶液中含有NH4+离子,溶液H中溶于CO2气体,生成沉淀I,则I为Al(OH)3,H为NaAlO2,说明溶液中含有Al3+离子,溶液中含有Fe2+离子,就一定不含NO3-离子,含有SO42-离子就一定不含Ba2+离子,不能确定是否含有的离子Fe3+和Cl-,以此解答(1)到(4)题,根据溶液电中性解答(5)题.
解答 解:(1)铁的核电荷数26,核外有四个电子层,位于元素周期表第四周期第Ⅷ族,故答案为:第四周期第Ⅷ族;
(2)在强酸性溶液中一定不会存在CO32-和SO32-离子,加入过量硝酸钡生成沉淀,则该沉淀为BaSO4沉淀,说明溶液中含有SO42-离子,生成气体A,A连续氧化生成D和E,则A为NO,D为NO2,E为HNO3,说明溶液中含有还原性离子,一定为Fe2+离子,溶液B中加入过量NaOH溶液,生成气体F,则F为NH3,说明溶液中含有NH4+离子,溶液H中溶于CO2气体,生成沉淀I,则I为Al(OH)3,H为NaOH和NaAlO2,说明溶液中含有Al3+离子,溶液中含有Fe2+离子,就一定不含NO3-离子,含有SO42-离子就一定不含Ba2+离子,不能确定是否含有的离子Fe3+和Cl-,检验方法是取少量X溶液放在试管中,加入几滴KSCN,溶液不变红色说明无Fe3+; 或者取少量B溶液放在试管中,加入几滴AgNO3溶液,无白色沉淀说明无Cl-,滴加KSCN溶液,若变红,则证明存在Fe3+,故答案为:Al3+、NH4+、Fe2+、SO42-;Fe3+、Cl-;取原溶液少量于试管中,滴加硝酸酸化的硝酸银溶液,若产生白色沉淀则证明存在Cl-或取原溶液少量于试管中,滴加KSCN溶液,若变红,则证明存在Fe3+(写出一种即可);
(3)Fe2+离子被氧化为Fe3+离子,加入NaOH溶液后生成Fe(OH)3,故答案为:Fe(OH)3;
(4)①Fe2+离子被氧化为Fe3+离子,反应的离子方程式为3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O;故答案为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O;
②H为NaOH和NaAlO2混合物,通入过量二氧化碳后分别发生的反应为:CO2+OH-=HCO3-,AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,
故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(5)A、F、I均为0.01mol,10mL X溶液中n(H+)=0.04mol,根据反应3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,可知离子为0.03mol,根据溶液电中性可知:2n(Fe2+)+3n(Al3+)+n(NH4+)=2n(SO42-),n(SO42-)=$\frac{2×0.03mol+3×0.01mol+0.01mol+0.04mol}{2}$=0.07mol,当沉淀C物质的量>0.07mol时一定含有Fe3+离子,反之,含有Cl-离子,即当沉淀C物质的量n<0.07mol,表明氯离子一定存在,故答案为:Cl-.
点评 本题为考查离子组推断题,题目具有一定难度,本题解答时一定要紧扣反应现象,推断各离子存在的可能性,本题易错点为(5)题,注意溶液电中性的利用.


科目:高中化学 来源: 题型:选择题
| A. | 产生BaSO4白色沉淀,溶液变红色 | B. | 产生BaSO3白色沉淀,溶液变无色 | ||
| C. | 无沉淀产生,溶液变无色 | D. | 产生BaSO4白色沉淀,溶液变无色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:选择题
现有如下三个热化学方程式:
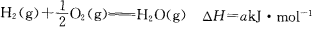
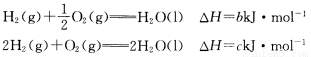
关于它们的下列表述正确的是( )
A.它们都是吸热反应 B.a、b和c均为正值
C.a=b D.2b=c
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 观察(得出Br2物理性质)→实验、观察→预测(推测Br2化学性质)→解释并得出结论 | |
| B. | 预测(推测Br2化学性质)→观察(得出Br2物理性质)→解释并得出结论→实验、观察 | |
| C. | 观察(得出Br2物理性质)→预测(推测Br2化学性质)→实验、观察→解释并得出结论 | |
| D. | 实验、观察→预测(推测Br2化学性质)→观察(得出Br2物理性质)→解释并得出结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化亚铁被氧化:4Fe(OH)2+2H2O+O2═4Fe(OH)3 | |
| B. | 铝与稀硝酸反应:2Al+6H+═2Al3++3H2↑ | |
| C. | 过氧化钠和水反应:2Na2O2+2H2O═4Na++4OH-+H2↑ | |
| D. | 向硅酸钠溶液中通入过量二氧化碳:SiO32-+CO2+H2O═H2SiO3+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
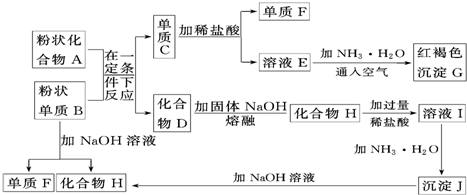
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
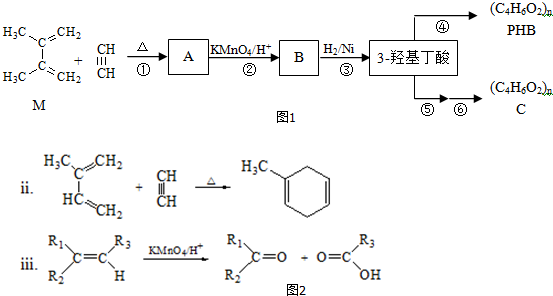
 .
. ;
;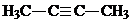 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com