

| A. | 图甲中,为检查装置的气密性,可关闭分液漏斗A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否复原 | |
| B. | 图已中,可以比较KMnO4、Cl2和S氧化性的相对强弱 | |
| C. | 将胶头滴管中的水滴入到金属钠中,能看到U型管右侧红墨水上升 | |
| D. | 图丁中,可用装置验证NaHCO3和Na2CO3的热稳定性强弱 |
分析 A.若气密性良好,将注射器活塞拉出一定距离后装置内压强减小,在大气压作用下活塞会回到原位;
B.氧化还原反应中,氧化性:氧化剂>氧化产物;
C.Na与水的反应为放热反应,大试管中气体体积增大;
D.大试管中温度较高,应该将碳酸钠固体放入大试管,将碳酸氢钠放入小试管.
解答 解:A.检查装置的气密性一般是利用气压的原理,在图2装置中,关闭A处活塞,将注射器的活塞拉出一定距离,过一段时间后再松开活塞,如活塞回到原位,说明气密性良好,否则漏气,故A正确;
B.图乙中,酸性高锰酸钾溶液能够将浓盐酸氧化成氯气,氯气能够氧化硫离子,据此可以比较KMnO4、Cl2和S氧化性的相对强弱,故B正确;
C.Na与水的反应为放热反应,大试管中气体体积增大,则能看到U型管右侧红墨水上升,故C正确;
D.比较NaHCO3和Na2CO3的稳定性时,应该将较稳定的Na2CO3放入温度较高的大试管中,将NaHCO3放入温度较低的小试管中,图示装置无法达到实验目的,故D错误;
故选D.
点评 本题考查化学实验方案的评价,涉及氧化还原反应及其能量变化、气密性检查、碳酸钠与碳酸氢钠的性质比较等知识,明确常见元素及其化合物性质为解答结构,注意掌握常见化学实验基本操作方法.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 将滤液蒸干,即可提取产品 (NH4)2SO4 | |
| B. | 通入足量氨气使悬浊液呈碱性有利于CO2的吸收 | |
| C. | 副产品是生石灰,X是CO2,其中CO2可循环利用 | |
| D. | 沉淀池中发生的主要反应为CaSO4+CO2+2NH3+H2O?CaCO3↓+(NH4)2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙分解 | B. | 甲烷在氧气中燃烧 | ||
| C. | 灼热的炭与二氧化碳反应 | D. | Ba(OH)2•8H2O与NH4Cl反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

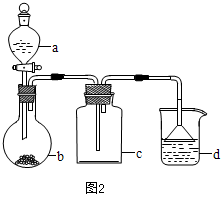
| 选项 | a物质 | b物质 | c收集的气体 | d中的物质 |
| A | 浓氨水 | NaOH | NH3 | H2O |
| B | 浓硫酸 | Na2SO3 | SO2 | 澄清石灰水 |
| C | 稀硝酸 | Cu | NO2 | H2O |
| D | 浓盐酸 | KMnO4 | Cl2 | NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe(NO3)x中的x为2 | |
| B. | 反应中每还原0.2 mol氧化剂,就有0.6 mol电子转移 | |
| C. | 稀HNO3在反应中只表现氧化性 | |
| D. | 氧化剂与还原剂的物质的量比为28:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M、N可能位于同一周期 | B. | M、N不可能位于同一主族 | ||
| C. | M、N可能形成共价化合物MN | D. | M、N可能形成离子化合物MN |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2g D216O中含有的质子数、中子数和电子数均为NA | |
| B. | 标准状况下,22.4L SO3含有的共价键数目为3NA | |
| C. | 80g CuO和Cu2S的混合物中,所含铜原子数为NA | |
| D. | 常温常压下,16g O2作氧化剂时转移电子数不一定为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com