
| 时间 水样 | 0 | 5 | 10 | 15 | 20 | 25 |
| Ⅰ(pH=2) | 0.4 | 0.28 | 0.19 | 0.13 | 0.10 | 0.09 |
| Ⅱ(pH=4) | 0.4 | 0.31 | 0.24 | 0.20 | 0.18 | 0.16 |
| Ⅲ(pH=4) | 0.20 | 0.15 | 0.12 | 0.09 | 0.07 | 0.05 |
| Ⅳ(pH=4,含Ca2+) | 0.20 | 0.09 | 0.05 | 0.03 | 0.01 | 0 |
| A. | 在0~20 min内,Ⅰ中M的分解速率为0.015 mol•L-1•min-1 | |
| B. | 水样酸性越强,M的分解速率越快 | |
| C. | 在0~20 min内,Ⅲ中M的分解百分率比Ⅱ大 | |
| D. | 由于Ca2+存在,Ⅳ中M的分解速率比Ⅰ快 |
分析 A.在0~20 min内,Ⅰ中M的物质的量浓度变化0.3mol/L,以此可计算浓度;
B.对比Ⅰ、Ⅱ组数据可得出结论;
C.在0~20 min内,Ⅲ中M的浓度变化0.13mol,Ⅱ中变化0.22mol,以此计算分解的百分率;
D.可对比0~20 min内Ⅰ、Ⅳ中M的分解速率进行判断.
解答 解:A.在0~20 min内,Ⅰ中M的物质的量浓度变化0.3mol/L,则,Ⅰ中M的分解速率为$\frac{0.3mol/L}{20min}$=0.015 mol•L-1•min-1,故A正确;
B.对比Ⅰ、Ⅱ组数据,0-5min内,Ⅰ中M的物质的量浓度变化0.12mol/L,Ⅱ中M的物质的量浓度变化0.09mol/L,则酸性增强,速率增大,故B正确;
C.在0~20 min内,Ⅲ中M的浓度变化0.13mol,分解速率为$\frac{0.13}{0.2}$,Ⅱ中变化0.22mol,分解速率为$\frac{0.22}{0.4}$,则Ⅲ中M的分解百分率比Ⅱ大,故C正确;
D.可对比5~10min内Ⅰ中分解速率为$\frac{0.09}{0.4}$、Ⅳ中M的分解速率为$\frac{0.04}{0.2}$,可知Ⅰ中M的分解速率比Ⅰ快,故D错误.
故选D.
点评 本题考查化学平衡的计算,为高频考点,侧重考查学生的分析、计算能力,注意把握数据的比较和计算,难度中等.


科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
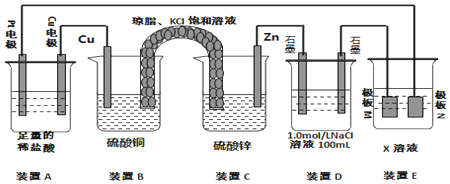
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol乙烷在光照条件下最多能与3 mol Cl2发生取代反应 | |
| B. | 石油裂解气能使溴的四氯化碳溶液、酸性KMnO4溶液褪色 | |
| C. | 水煤气可用来合成液态烃、甲醇等有机物 | |
| D. | 苯可通过取代反应制得硝基苯、氯苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L0.1mol•L-1NaClO溶液中,ClO-的数目为0.1NA | |
| B. | 常温常压下,11.2LCH4含有的共用电子对数目为2NA | |
| C. | 16gO2与O3混合气体中,氧原子的数目为1.5NA | |
| D. | 1molFe与足量Cl2完全反应后,转移的电子数目为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
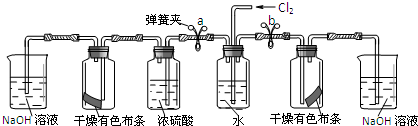
| 步骤 | 实验操作 | 预期现象和结论 |
| ① | 松开a处弹簧夹,夹上b处弹簧夹 | 装置左边集气瓶中的有色布条不褪色 删去,证明猜想一不正确. |
| ② | 松开b处弹簧夹,夹上a处弹簧夹 | 装置右边集气瓶中的有色布条褪色, 说明猜想二正确. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | W的气态氢化物的沸点一定高于Z的气态氢化物的沸点 | |
| B. | W与X形成的化合物中只含离子键 | |
| C. | X、Y、Z、W的原子半径依次减小 | |
| D. | 若W与Y原子序数相差5,则二者形成化合物的化学式一定为Y2W3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子总数为NA的NO2和CO2混合气体含有的氧原子数为2NA | |
| B. | 含有NA个原子的氢气在标准状况下的体积约为11.2 L | |
| C. | 常温常压下,92 g的NO2和N2O4混合气体含有的原子数为6NA | |
| D. | 40 g NaOH溶解在1 L水中,所制得的100 mL溶液中含Na+数为0.1 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com