
 )为原料,制取苯甲酸甲酯.已知有关物质的沸点如表:
)为原料,制取苯甲酸甲酯.已知有关物质的沸点如表:| 物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
| 沸点/℃ | 64.7 | 249 | 199.6 |
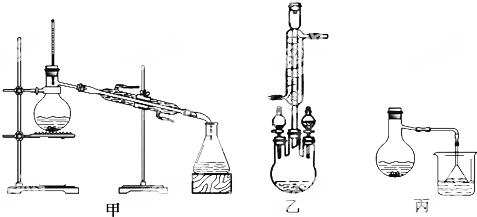

分析 Ⅰ.合成苯甲酸甲酯粗产品
(1)酯化反应机理为酸脱羟基醇脱氢,据此写出该反应的化学方程式,根据酯化反应中浓硫酸的作用进行解答;
(2)根据甲图、乙图装置的圆底烧瓶上没有冷凝管及甲醇易挥发进行分析;
Ⅱ.粗产品的精制
(3)分液用于分离两种不互溶的液体,蒸馏用于互溶但沸点相差较大的两种(或两种以上)液体分离;
(4)氢氧化钠是强碱,促进苯甲酸甲酯的水解,据此答题;
(5)产率=$\frac{实际产量}{理论产量}$×100%,根据反应物的物质的量判断过量,根据不足量计算出理论上生成苯甲酸甲酯的物质的量,再计算出其产率.
解答 解:Ⅰ.合成苯甲酸甲酯粗产品
(1)苯甲酸与甲醇在浓硫酸作用下的酯化反应为:苯甲酸脱去羟基,据此脱去羟基中的氢原子,二者反应生成苯甲酸甲酯,所以水中18O原子来自苯甲酸,反应的化学方程式为:C6H5CO18OH+CH3OH $\frac{\underline{\;浓硫酸\;}}{△}$C6H5COOCH3+H218O,浓硫酸在酯化反应中起到了催化剂作用,酯化反应为可逆反应,浓硫酸吸收反应生成的水,可以促进酯的生成,浓硫酸起到了吸水剂的作用,
故答案为:C6H5CO18OH+CH3OH $\frac{\underline{\;浓硫酸\;}}{△}$C6H5COOCH3+H218O;催化剂、吸水剂;
(2)由装置图可知,乙图的圆底烧瓶上有冷凝管,充分起到回流作用,甲图和丙图则没有,而本题中反应物甲醇沸点低,苯甲酸、苯甲酸甲酯的沸点远高于甲醇,若采用甲图、丙图,甲醇必定会大量挥发,不利于合成反应,所以应冷凝回流,减少甲醇的挥发,提高产率,
故答案为:乙;
Ⅱ.粗产品的精制
(3)苯甲酸甲酯不溶于水,操作Ⅰ分离出互不相溶的液体,通常采用分液操作完成;甲醇和苯甲酸甲酯相互溶解,二者沸点不同,可以通过蒸馏操作分离,
故答案为:分液;蒸馏;
(4)氢氧化钠是强碱,促进苯甲酸甲酯的水解,所以不能用NaOH溶液代替饱和碳酸钠溶液,
故答案为:否;氢氧化钠是强碱,促进苯甲酸甲酯的水解,导致产品损失;
(5)12.2g苯甲酸的物质的量为:$\frac{12.2g}{122g/mol}$=0.1mol,20mL甲醇(密度约0.79g/mL)的物质的量为:$\frac{0.79g/ml×20ml}{32g/mol}$=0.49mol>0.1mol,
则理论上生成苯甲酸甲酯的物质的量为:0.1mol,质量为:136g/mol×0.1mol=13.6g,则苯甲酸甲酯的产率为:$\frac{8.84g}{13.6g}$×100%=65%,
故答案为:65%.
点评 本题通过苯甲酸甲酯的制备方法,考查了物质制备方案的设计与评价,题目难度中等,明确物质的制备原理为解答此类题的关键,该烃为乙酸乙酯的制备知识的迁移题目,充分考查了学生灵活应用所学知识的能力.


科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,两种气体的体积之比等于摩尔质量之比 | |
| B. | 常温常压下,两种气体的物质的量之比等于密度之比 | |
| C. | 同温同压下,两种气体的摩尔质量之比等于密度反比 | |
| D. | 同温同体积时,两种气体的物质的量之比等于压强之比 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯乙烯分子的结构简式:H3C-CH2Cl | B. | 硫原子的结构示意图: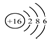 | ||
| C. | 过氧化钠的电子式: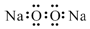 | D. | 中子数为10的氧原子:${\;}_{8}^{10}$O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
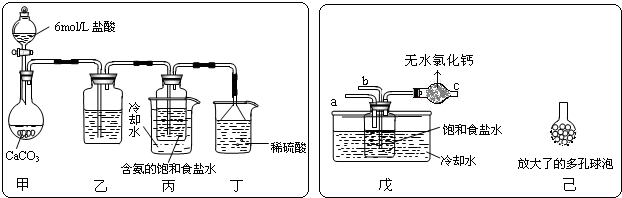
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
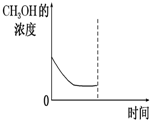 甲醚作为一种基本化工原料,由于其良好的易压缩、冷凝、汽化特性,使甲醚在制药、燃料、农药等化学工业中有许多独特的用途.
甲醚作为一种基本化工原料,由于其良好的易压缩、冷凝、汽化特性,使甲醚在制药、燃料、农药等化学工业中有许多独特的用途.| 物质 | CH3OH | CH3OCH3 | H2O |
| c(mol•L-1) | 0.8 | 1.24 | ? |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 | 相对分子质量 | 密度/g•cm-3 | 沸点/℃ | 水中溶解性 | |
| 乙酸 | 60 | 1.051 | 118.0 | 溶 | |
| 环己醇 | 100 | 0.982 | 160.8 | 微溶 | |
| 乙酸环己酯 | 142 | 0.969 | 173.5 | 难溶 |
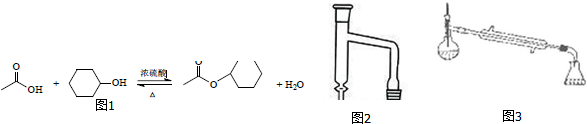
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 物质A、B的转化率之比为1:2 | |
| B. | 起始时刻和达平衡后容器中混合气体密度相等 | |
| C. | 当v正(A)=2v逆(C)时,可断定反应达到平衡状态 | |
| D. | 若起始时放入3 mol A和3 mol B,则达平衡时生成 3a mol C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
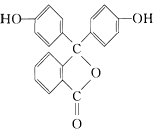
| A. | 1mol酚酞最多与2molNaOH发生中和反应 | |
| B. | 酚酞分子中所有碳原子不可能共平面 | |
| C. | 酚酞结构中有三个苯环,属于芳香烃 | |
| D. | 酚酞的分子式为C20H14O4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com