
| A�� | Zn��s��+CuSO4��aq���TZnSO4��aq��+Cu��s����H=-216 kJ/mol��E��Ӧ����E������ | |
| B�� | CaCO3��s���TCaO��s��+CO2��g����H=+178.2 kJ/mol��E��Ӧ����E������ | |
| C�� | HCl��g���T$\frac{1}{2}$H2��g��+$\frac{1}{2}$Cl2��g����H=+92.3 kJ/mol��1 mol HCl���ܱ������зֽ��ų�92.3 kJ������ | |
| D�� | H+��aq��+OH-��aq���TH2O��l����H=-57.3 kJ/mol����1 mol NaOH���ռ���Һ�뺬0.5 mol H2SO4��ŨH2SO4��Ϻ�ų�57.3 kJ������ |
���� A��Ϊ���ȷ�Ӧ����Ӧ��������������������������
B��Ϊ���ȷ�Ӧ����Ӧ��������С����������������
C��HCl�ֽ�����������
D��Ũ��������ˮ���ȣ�
��� �⣺A��Ϊ���ȷ�Ӧ����Ӧ����������������������������E��Ӧ����E������������A����
B��Ϊ���ȷ�Ӧ����Ӧ��������С������������������E��Ӧ����E����������B��ȷ��
C��HCl��g���T$\frac{1}{2}$H2��g��+$\frac{1}{2}$Cl2��g��Ϊ���ȷ�Ӧ����HCl�ֽ�������������C����
D��Ũ��������ˮ���ȣ���ų���������57.3 kJ����D����
��ѡB��
���� ���⿼�鷴Ӧ�����ʱ䣬Ϊ��Ƶ���㣬���շ�Ӧ�������仯Ϊ���Ĺؼ������ط�����Ӧ�������Ŀ��飬ע��ѡ��DΪ�״��㣬��Ŀ�ѶȲ���


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | $\frac{r��{F}^{-}��}{r��M{g}^{2+}��}$ | B�� | $\frac{r��N{a}^{+}��}{r��M{g}^{2+}��}$ | C�� | $\frac{r��Cl��}{r��C{l}^{-}��}$ | D�� | $\frac{r��Na��}{r��N{a}^{+}��}$ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��SO2����ͨ��NaClO��Һ�У�SO2+2ClO-+H2O�TSO32-+2HClO | |
| B�� | ��NaAlO2��Һ��ͨ�����CO2��Al��OH��3��AlO2-+CO2+2H2O�TAl��OH��3��+HCO3- | |
| C�� | ��Na2S2O3��Һ��ͨ������������S2O32-+2Cl2+3H2O�T2SO32-+4Cl-+6H+ | |
| D�� | ��ⱥ��MgCl2��Һ��2Cl-+2H2O$\frac{\underline{\;���\;}}{\;}$ 2OH-+H2��+Cl2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
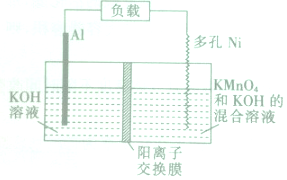 Licht�ȿ�ѧ����Ƶ�Al-MnO4-���ԭ����ͼ��ʾ������ܷ�ӦΪAl+MnO4-�TAlO2-+MnO2������˵����ȷ���ǣ�������
Licht�ȿ�ѧ����Ƶ�Al-MnO4-���ԭ����ͼ��ʾ������ܷ�ӦΪAl+MnO4-�TAlO2-+MnO2������˵����ȷ���ǣ�������| A�� | ��ع���ʱ��K+�����ƶ� | |
| B�� | Al�缫������ԭ��Ӧ | |
| C�� | �����ĵ缫��ӦʽΪMnO4-+4H++3e-�TMnO2+2H2O | |
| D�� | �����ϵ�·��ÿͨ��1mol���ӣ�������������9g |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ��� | ʵ������ | ʵ��Ŀ�� |
| A | �ⶨ��ͬ���ʵ���Ũ�ȵ�KOH�Ͱ�ˮ��pH | ֤����ˮ�д��ڵ���ƽ�� |
| B | �����NaCl��NaOH��Һ�е�����֪Ũ�ȵ����ᣨ�÷�̪��ָʾ���� | �ζ�����NaOH���� |
| C | ��Mg��Al��NaOH��Һ���Ϊԭ��� | �Ƚ�Mg��Al������ǿ�� |
| D | �ö��Ե缫��ⱥ��ʳ��ˮ�����������μӷ�̪ | ��֤�����м����� |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ������һ�ָ���ȼ�ϣ�Ҳ�㷶Ӧ���ڹ�ҵ�ϳ��У�
������һ�ָ���ȼ�ϣ�Ҳ�㷶Ӧ���ڹ�ҵ�ϳ��У��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� |  ϡ��Ũ���� | B�� |  ��ˮ�����Ȼ��� | C�� | 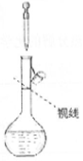 ��ˮ���� | D�� |  ʵ�����ư��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
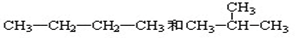

�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com