
| A、pH=7的溶液:Fe3+、NH4+、Cl-、NO3- |
| B、pH=2的溶液:Fe2+、Al3+、Cl-、NO3- |
| C、能使甲基橙显黄色的溶液:Cl-、CO32-、K+、AlO2- |
| D、与铝反应产生大量氢气的溶液:[Ag(NH3)2]+、Na+、CH3COO-、NH4+ |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
A、聚丙烯酸钠的结构式为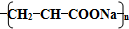 |
| B、聚丙烯酸钠可以通过单体发生缩聚反应制得 |
| C、聚丙烯酸钠具有热塑性 |
| D、聚丙烯酸钠是一种体型结构的高分子材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 原子序数之和为16的三种短周期元素的单质X、Y、Z,常温常压下均为无色气体,在适当条件下X、Y、Z之间可以发生如右图所示的变化.已知B分子组成中Z原子个数比C分子中少一个.
原子序数之和为16的三种短周期元素的单质X、Y、Z,常温常压下均为无色气体,在适当条件下X、Y、Z之间可以发生如右图所示的变化.已知B分子组成中Z原子个数比C分子中少一个.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、肯定不存在的离子是Fe3+、Cu2+、NH4+、SO42-、CO32- |
| B、肯定存在的离子是SO32-、Br-; Na+、K+离子至少有一种存在 |
| C、无法确定原溶液中是否存在Cl- |
| D、若步骤④改用BaCl2和盐酸的混合溶液,则对溶液中离子的判断有影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe2++Cl2→Fe3++2Cl- |
| B、2Fe2++2Br-+2I-+3C12→2Fe3++I2+Br2+6Cl- |
| C、2Fe2++4Br-+2I-+4Cl2→2Fe3++I2+2Br2+8Cl- |
| D、4Fe2++2Br-+2I-+4Cl2→4Fe3++I2+Br2+8Cl- |
| E、4Fe2++2Br-+2I-+4Cl2→4Fe3++I2+Br2+8Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、亚硫酸的电离:H2SO3?2H++SO32- |
| B、氯化铵水解的离子方程式为:NH4++H2O?NH3?H2O+H+ |
| C、NaHCO3水解的离子方程式为:HCO3-+H2O?CO32-+H3O+ |
| D、向氯化铝溶液中加入过量的氨水:A13++3NH3?H2O=Al(OH)3↓+3NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
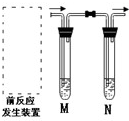 实验室用如图装置完成表中的四个实验,不能得到实验目的是( )
实验室用如图装置完成表中的四个实验,不能得到实验目的是( )
| 选项 | 实验目的 | M | N |
| A | 检验铜与浓硫酸反应的气体产物 | 品红 | NaOH |
| B | 检验CH3CH2Br消去后产生的气体 | 水 | KMnO4溶液 |
| C | 制取乙炔时检验气体产物 | CuSO4溶液 | KMnO4溶液 |
| D | 验证醋酸、碳酸、苯酚酸性强弱 | NaOH溶液 | 苯酚钠溶液 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
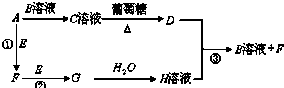 元素及其化合物在生产、生活中具有广泛的用途.
元素及其化合物在生产、生活中具有广泛的用途.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com