
����Ŀ��T ��ʱ����2 L�ܱ�������ʹX(g)��Y(g)������Ӧ����Z(g)����Ӧ������X��Y��Z��Ũ�ȱ仯��ͼ1��ʾ�������������������䣬�¶ȷֱ�ΪT1��T2ʱ��Y������ٷֺ�����ʱ��Ĺ�ϵ��ͼ2��ʾ�������н�������ȷ����

A�������з����ķ�Ӧ�ɱ�ʾΪ��3X(g)��Y(g) ![]() 2Z(g)
2Z(g)
B����Ӧ���е�ǰ3 min�ڣ���X��ʾ�ķ�Ӧ���� v(X)��0.3mol��(L��min)
C����ͼ2��֪�������T1���¶�ΪT2ʱ����ﵽ���յ�����˵��T2ʱ��ѧ��Ӧ���ʸ��죬��ȷ���¶�T2����T1
D�����ı䷴Ӧ������ʹ��Ӧ������ͼ3��ʾ����ı������������ʹ���˴���
���𰸡�B
��������
���������A����ͼ1֪��X�����ʵ���������Ϊ(2.0-1.4)mol=0.6mol��Y�����ʵ���������Ϊ(1.6-1.4)mol=0.2mol��X��YΪ��Ӧ�Z�����ʵ���������Ϊ(0.8-0.4)mol=0.4mol��ZΪ�����ͬһ��ѧ��Ӧͬһʱ����ڣ���Ӧ����ٵ����ʵ��������������ӵ����ʵ���֮�ȵ����������֮�ȣ�����X��Y��Z�ļ�����֮��=0.6mol��0.2mol��0.4mol=3��1��2�����Է�Ӧ�ɱ�ʾΪ��3X(g)+Y(g) ![]() 2Z(g)����A��ȷ��B��v=
2Z(g)����A��ȷ��B��v=![]() =
=![]() =0.1mol/(L��min)����B����C���¶�Խ�ߣ���Ӧ����Խ�죬����ƽ����Ҫ��ʱ��Խ�̣���C��ȷ��D��ͼ3��ͼ1�Ƚϣ�ͼ3����ƽ�����õ�ʱ��϶̣�˵����Ӧ��������ƽ��״̬û�з����ı䣬Ӧ�Ǽ���������£���D��ȷ����ѡB��
=0.1mol/(L��min)����B����C���¶�Խ�ߣ���Ӧ����Խ�죬����ƽ����Ҫ��ʱ��Խ�̣���C��ȷ��D��ͼ3��ͼ1�Ƚϣ�ͼ3����ƽ�����õ�ʱ��϶̣�˵����Ӧ��������ƽ��״̬û�з����ı䣬Ӧ�Ǽ���������£���D��ȷ����ѡB��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и������ǿ����ʡ�������ʡ��ǵ���ʵĹ��࣬��ȫ��ȷ����
ѡ�� | ǿ����� | ������� | �ǵ���� |
A | CaCO3 | HF | SO2 |
B | NaCl | NH3 | BaSO4 |
C | Fe | HCl | ���� |
D | HNO3 | Fe(OH)3 | MgO |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о������к�����(��Ҫ��SO2��H2S)��ת��������Ҫ���塣
��1����ʪ��������д��������SO2ת��ΪHSO3-������ʽ�� ��
��2�������е��������������H2S��������Ӧ������SO42-��������Ӧ�������仯ʾ��ͼ������
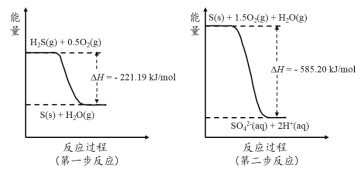
1mol H2S(g)ȫ��������SO42-(aq)������ѧ����ʽΪ ��
��3���������������ӽ���Ĥȼ�ϵ�ؿ������ô�������SO2������������װ��ʾ��ͼ���£�
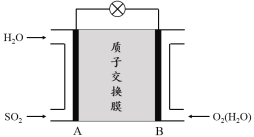
�� ��������������Ϊ ������A��B��������B��A������
�� �������缫��ӦʽΪ ��
��4��ȼú���������������Ǽ�����������������Ⱦ���ؼ���SO2�����ѳ���һ����ҵ�������£�
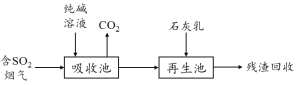
�ô�����Һ����SO2����ת��ΪHSO3-����Ӧ�����ӷ���ʽ�� ��
��ʯ��������������������Ż����ճأ����п���������SO2�������Ļ�ѧʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ���ܴﵽĿ�ĵ��ǣ� ��
A�����Ҵ���Ũ�����ȥ���������е���������
B����NaOH��Һ��FeCl3��Һ�Ʊ�Fe(OH)3����
C����Ʒ����������Na2SO3��Na2CO3
D����������ϩ��SO2ͨ������KMnO4��Һ�г�ȥ��ϩ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����( )
A��ͬ��ͬѹ�£�H2(g)+Cl2(g)=2HCl(g)�ڹ��պ͵�ȼ�����µĦ�H��ͬ
B����֪����ı�ȼ����Ϊ��H=-890.3 kJ/mol �����ȼ���ȵ��Ȼ�ѧ����ʽΪ��CH4 (g) + 2O2 (g) = CO2(g) + 2H2O(g) ��H=-890.3 kJ/mol
C��һ�������£�0.5 mol N2 ��1.5 mol H2���ܱ������г�ַ�Ӧ����NH3������19.3 kJ�����Ȼ�ѧ����ʽΪ��N2 (g)+ H2 (g)![]() 2NH3(g) ��H =-38.6 kJ/mol
2NH3(g) ��H =-38.6 kJ/mol
D��2H+(aq)+SO42-(aq)+Ba2+(aq)+2OH-(aq)=BaSO4(s)+2H2O(l)��H=-57.3kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������β���ﺬ�е�NO������������ȼ��ȼ�յĸ�����������������Ӧ���£�N2(g)��O2(g)![]() 2NO(g)��H��0����֪�÷�Ӧ��2404��ʱ��ƽ�ⳣ��K��64��10��4����ش�
2NO(g)��H��0����֪�÷�Ӧ��2404��ʱ��ƽ�ⳣ��K��64��10��4����ش�
��1��ij�¶��£���2 L���ܱ������г���N2��O2��1 mol��5���Ӻ�O2�����ʵ���Ϊ0.5 mol����N2�ķ�Ӧ����Ϊ_________________��
��2���ٶ��÷�Ӧ���ں��������½��У��жϸ÷�Ӧ�ﵽƽ��״̬�ı�־__________��
A������1 mol N2ͬʱ����1 mol O2 B����������ܶȲ���
C���������ƽ����Է����������� D��2v��(N2)��v��(NO)
��3����N2��O2�Ļ�����������º����ܱ������У���ͼ�仯������ȷ����________(����ĸ���)��
��4������º��ݵ��ܱ������г�������ʵ�����N2��O2���ﵽƽ��״̬���������г���һ����NO�����´ﵽ��ѧƽ��״̬����ԭƽ��״̬��ȣ���ʱƽ��������NO���������________��(���������������С������������)
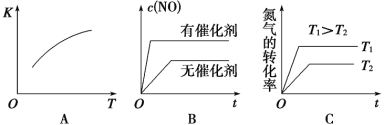
��5�����¶��£�ijʱ�̲��������N2��O2��NO��Ũ�ȷֱ�Ϊ2.5��10��1 mol/L��4.0��10��2 mol/L��3.0��10��3 mol/L����ʱ��Ӧ_____________(�������ڻ�ѧƽ��״̬������������Ӧ����������������淴Ӧ���������)��������_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����·�Ӧ�ᵼ����Һ�����Լ��������Ե���( )
A. Na2SO4��Һ����BaCl2����
B. Ba(OH)2��Һ�м���CuSO4(����)����
C. NaOH��Һͨ��HCl
D. H2O���NaCl����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڹ̶�������ܱ������н��е����巴Ӧ����˵��A(g) + B��g��![]() C��g��+D��g���ں������Ѵﵽƽ�����
C��g��+D��g���ں������Ѵﵽƽ�����
A����Ӧ������ѹǿ����ʱ����仯
B��A�����B����������������
C��A��B��C��������������������
D����Ӧ���������ܶȲ���ʱ����仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�ڳ��³�ѹ�£�
��2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ��H=-1451.6kJ/mol
��2CO(g)+O2(g)=2CO2(g) ��H=-566.0kJ/mol
(1)д���״�����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽ_______________
(2)ijС����ݼ״�ȼ�յķ�Ӧԭ���������ͼ��ʾ�ĵ��װ�ã�
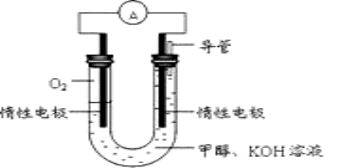
�õ�������ĵ缫��Ӧʽ____________________
����һ��ʱ������Һ��pH______________(������С��)����õ���ܷ�Ӧ�����ӷ���ʽ__________________
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com