
【题目】下列有关图示的说法正确的是

A. 图甲表示CH4 (g)+2O2 (g)=CO2 (g)+2H2O(1)的能量变化
B. 图乙表示压强对2A(g)+2B(g)![]() 3C(g)+D(g)的影响,且压强:P甲>P乙
3C(g)+D(g)的影响,且压强:P甲>P乙
C. 图丙表示温度对N2 (g)+3H2(g)![]() NH3 (g) △H<0的影响
NH3 (g) △H<0的影响
D. 图丁表示N2 (g)+3H2(g)![]() 2NH3 (g)平衡时NH3体积分数随起始n(N2)/n(H2)的变化,则转化率:αA(H2)=αB(H2)
2NH3 (g)平衡时NH3体积分数随起始n(N2)/n(H2)的变化,则转化率:αA(H2)=αB(H2)
【答案】C
【解析】A、CH4 (g)+2O2 (g)=CO2 (g)+2H2O(1)是放热反应;B、对应反应速率越大,压强越大。C、放热反应,随反应进行温度升高,达到平衡后,升高温度,平衡逆向移动。D.增加反应物中一种物质的含量,可使得另一反应物的转化率增加。
A、CH4 (g)+2O2 (g)=CO2 (g)+2H2O(1)是放热反应,图甲表示为吸反应,故A错误;B、图乙表示压强对2A(g)+2B(g)![]() 3C(g)+D(g)的影响,乙的速率大,对应压强大,P甲<P乙,故B错误;C、N2 (g)+3H2(g)
3C(g)+D(g)的影响,乙的速率大,对应压强大,P甲<P乙,故B错误;C、N2 (g)+3H2(g)![]() NH3 (g) △H<0是放热反应,随反应进行温度升高,达到平衡后,升高温度,平衡逆向移动,故氮气的体积分数先降低后升高,故C正确。D、n(N2)/n(H2)越大,氮气的体积分数越大,氢气的转化率越大,故D错误。故选C。
NH3 (g) △H<0是放热反应,随反应进行温度升高,达到平衡后,升高温度,平衡逆向移动,故氮气的体积分数先降低后升高,故C正确。D、n(N2)/n(H2)越大,氮气的体积分数越大,氢气的转化率越大,故D错误。故选C。


科目:高中化学 来源: 题型:
【题目】ClO2 是一种高效安全的杀菌消毒剂。用氯化钠电解法生成ClO2的工艺原理示意图如下图, 发生器内电解生成ClO2。下列说法正确的是

A. a气体是氯气,b气体是氢气
B. 氯化钠电解槽内每生成2 mol a气体,转移2mol e-
C. ClO2发生器中阴极的电极反应式为:ClO3- + 2H+ + e-![]() ClO2↑ + H2O
ClO2↑ + H2O
D. 为使a、b气体恰好完全反应,理论上每生产1molClO2需要补充44.8Lb气体(标况下)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物E是一种医药中间体,常用于制备抗凝血药,可以通过如图所示的路线合成: 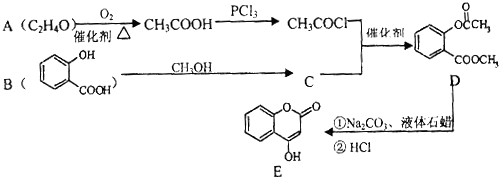
(1)A中含有的官能团名称为 .
(2)C转化为D的反应类型是 .
(3)写出D与足量NaOH溶液完全反应的化学方程式: .
(4)1mol E最多可与mol H2加成.
(5)写出同时满足下列条件的B的一种同分异构体的结构简式: . A.能发生银镜反应
B.核磁共振氢谱只有4个峰
C.能与FeCl3溶液发生显色反应
D.水解时每摩尔可消耗3mol NaOH
(6)已知工业上以氯苯水解制取苯酚,而酚羟基一般不易直接与羧酸酯化.苯的同系物可以被酸性KMnO4溶液氧化: ![]() 苯甲酸苯酚酯
苯甲酸苯酚酯 ![]() 是一种重要的有机合成中间体.试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任选).
是一种重要的有机合成中间体.试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任选).
合成路线流程图示例如下:H2C=CH2 ![]() CH3CH2Br
CH3CH2Br ![]() CH3CH2OH.
CH3CH2OH.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝热反应有广泛的用途,实验装置如下图1所示。下列说法正确的是

A. 铝热反应的能量变化可用图2表示
B. 工业上可用铝热反应的方法提取镁
C. 在铝热反应过程中没有涉及到的化学反应类型是化合反应
D. 该铝热反应的化学方程式是8Al+3Fe3O4![]() 4Al2O3+9Fe
4Al2O3+9Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组称取纯净的Na2SO3 ·7H20 a克,隔绝空气加强热至恒重,经过分析与计算,得到的固体质量与全部转化为亚硫酸钠固体的计算值一致,但固体在水中溶解后测的pH值比理论计算值(相同浓度Na2SO3溶液的pH)大很多。下列说法不正确的是
A. 连续两次称量强热前后固体的质量,如质量差小于0.1g,即可判断固体已经恒重
B. 产生上述矛盾的可能解释:4Na2SO3 ![]() 3Na2SO4 + Na2S
3Na2SO4 + Na2S
C. 固体产物中加入稀盐酸可能有淡黄色沉淀产生
D. 加入BaCl2溶液,出现白色沉淀,则能确定产物中有Na2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生石灰是常用的建筑材料,常采用煅烧石灰石来制取。体积为1L的真空密闭容器中加入0.5moL碳酸钙,发生的反应CaCO3(s)![]() CaO(s)+CO2(g)△H ,测得二氧化碳的物质的量浓度随温度变化关系如图所示。
CaO(s)+CO2(g)△H ,测得二氧化碳的物质的量浓度随温度变化关系如图所示。
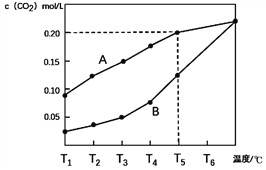
图A表示CO2的平衡浓度随温度变化的关系曲线
图B表示不同温度下反应经过相同时间时CO2的物质的量浓度的变化曲线
回答下列相关问题:
(1)CaCO3(s)![]() CaO(s)+CO2(g) △H ____ 0(填>,<或=)。
CaO(s)+CO2(g) △H ____ 0(填>,<或=)。
(2)在T5℃下,维持温度和容器体积不变,向上述平衡体系再充入0.5moL氮气,则最后的平衡时容器中的碳酸钙质量为____克;若在T5℃下,维持温度和总压强不变,向原平衡体系再充入0.5moL氮气,则容器中最后残留的碳酸钙质量为____克。
(3)请说明随着温度升高,曲线B向曲线A逼近的原因____
(4)以CaO为吸收体,将生物材质(以C计)与水蒸气反应制取H2。
相关主要反应如下:
I. C(s) + H2O(g)![]() CO(g) + H2(g) △H = + 131. 6 kJ·mol-1
CO(g) + H2(g) △H = + 131. 6 kJ·mol-1
II. CO(g) + H2O(g)![]() CO2(g) + H2(g) △H = -43 kJ·mol-1
CO2(g) + H2(g) △H = -43 kJ·mol-1
III. CaO(s)+CO2(g)![]() CaCO3(s) △H = -178. 3 kJ·mol-1
CaCO3(s) △H = -178. 3 kJ·mol-1
①计算反应Ⅳ C(s) + 2H2O(g) + CaO(s)![]() CaCO3(s) + 2H2 (g)的△H =____kJ·mol-1。
CaCO3(s) + 2H2 (g)的△H =____kJ·mol-1。
若K1、K2、K3分别为反应I、II、III的平衡常数,则反应Ⅳ的平衡常数K=____
(用含K1、K2、K3的式子表示)。
②对于可逆反应 C(s)+2H2O(g)+CaO(s)![]() CaCO3(s) + 2H2(g),采取以下措施可以提高H2产率的是____。(填字母编号)
CaCO3(s) + 2H2(g),采取以下措施可以提高H2产率的是____。(填字母编号)
A. 适当的降低体系的温度 B. 压缩容器的体积
C. 用镧镍合金(LaNi5)吸收氢气 D. 增加CaO的量
(5)将碳酸钙固体与CO2饱和水溶液充分接触,某温度下CO2饱和水溶液中H2CO3的浓度0.03moL·L-1,水的pH约等于6,这种情况下钙离子最大浓度为____moL·L-1 。(计算结果保留两位有效数字)(CaCO3的KSP=2.8×10-9,碳酸K1=4.3×10-7 K2=4.7×10-11)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在蒸馏实验中,下列叙述不正确的是( )
A.用锥形瓶来接收冷凝出的液体B.将温度计水银球插入蒸馏烧瓶中的液面下
C.冷水从冷凝管下口进入,上口流出D.加入沸石的作用是防止液体暴沸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com