
【题目】![]() 、
、![]() 用途广泛。请回答下列问题:
用途广泛。请回答下列问题:
(1)常温时,![]()
![]() 溶液的
溶液的![]() 。
。
则溶液中![]() ______c
______c![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() ;
;![]() ______
______![]() 填数值
填数值![]() 。
。
(2)![]() 时,
时,![]()
![]() 溶液的pH小于3,分析导致pH随温度变化的原因是__________________________________________
溶液的pH小于3,分析导致pH随温度变化的原因是__________________________________________![]() 用离子方程式并结合文字叙述回答
用离子方程式并结合文字叙述回答![]() 。
。
(3)常温时,向100mL![]()
![]() 溶液中滴加
溶液中滴加![]() NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示。向
NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示。向![]() 溶液中滴加NaOH溶液到a点的过程中,发生反应的离子方程式为_________________。
溶液中滴加NaOH溶液到a点的过程中,发生反应的离子方程式为_________________。
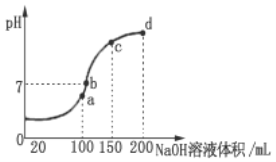
(4)浓度均为![]() 溶液和
溶液和![]() 溶液,其中______溶液
溶液,其中______溶液![]() 大。
大。
【答案】![]()
![]() 或
或![]()
![]() 、
、![]() 存在水解平衡:
存在水解平衡:![]() 、
、![]() ,升高促进水解,
,升高促进水解,![]() 增大,pH减小
增大,pH减小 ![]()
![]()
【解析】
(1)本题考查物料守恒和电荷守恒,根据物料守恒,以及NH4Al(SO4)2,推出c(NH4+)+c(NH3·H2O)=c(Al3+)+c[Al(OH)3],根据电荷守恒,c(NH4+)+3c(Al3+)+c(H+)=c(OH-)+2c((SO42-);
(2)本题考查影响盐类水解的因素,NH4Al(SO4)2溶液显酸性,是因为存在NH4++H2O![]() NH3·H2O+H+、Al3++3H2O
NH3·H2O+H+、Al3++3H2O![]() Al(OH)3+3H+;
Al(OH)3+3H+;
(3)本题考查滴定实验,NH4HSO4的电离方程式为NH4HSO4=NH4++H++SO42-;
(4)本题考查影响盐类水解的因素,Al3+、H+都抑制NH4+的水解,H+抑制NH4+水解能力强。
(1)根据物料守恒,以及NH4Al(SO4)2,推出c(NH4+)+c(NH3·H2O)=c(Al3+)+c[Al(OH)3],根据电荷守恒,c(NH4+)+3c(Al3+)+c(H+)=c(OH-)+2c((SO42-),因此有2c(SO42-)-c(NH4+)-3c(Al3+)=c(H+)-c(OH-)=10-3-10-11;
(2)NH4Al(SO4)2中铵根离子和铝离子水解,溶液显酸性,是因为存在NH4++H2O![]() NH3·H2O+H+、Al3++3H2O
NH3·H2O+H+、Al3++3H2O![]() Al(OH)3+3H+,盐类水解是吸热反应,升高温度,促进水解,c(H+)
Al(OH)3+3H+,盐类水解是吸热反应,升高温度,促进水解,c(H+)
(3)NH4HSO4的电离方程式为NH4HSO4=NH4++H++SO42-,H+结合OH-能力强于NH4+,在a点时通入NaOH的体积为100mL,恰好中和NH4HSO4电离出H+,因此离子反应方程式为H++OH-=H2O;(4)本题考查影响盐类水解的因素,Al3+、H+都抑制NH4+的水解,H+抑制NH4+水解能力强,即NH4HSO4溶液中c(NH4+)大。


科目:高中化学 来源: 题型:
【题目】反应Fe+H2SO4=FeSO4+H2↑的能量变化趋势,如图所示:
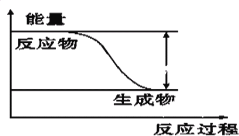
(1)该反应为______反应(填“吸热”或“放热”)。
(2)若要使该反应的反应速率加快,下列措施可行的是______(填字母)。
A.改铁片为铁粉 B.增大压强 C.升高温度 D.将稀硫酸改为98%的浓硫酸
(3)若将上述反应设计成原电池,铜为原电池某一极材料,则铜为____极(填“正”或“负”)。铜片上产生的现象为______,该极上发生的电极反应为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲测定某NaOH溶液的物质的量浓度,可用0.1000mol·L-1HCl标准溶液进行中和滴定(用甲基橙作指示剂)。
请回答下列问题:
(1)滴定时,盛装待测NaOH溶液的仪器名称为 ,盛装标准盐酸的仪器名称为 ;滴定至终点的颜色变化为 。
(2)若甲学生在实验过程中,记录滴定前滴定管内液面读数为0.50mL,滴定后液面如图,则此时消耗标准溶液的体积为 。

(3)乙学生做了三组平行实验,数据记录如下:
实验序号 | 待测NaOH溶液的体积/mL | 0.1000mol·L-1HCl溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 0.00 | 26.29 |
2 | 25.00 | 1.56 | 31.30 |
3 | 25.00 | 1.00 | 27.31 |
选取上述合理数据,计算出待测NaOH溶液的物质的量浓度为 (保留四位有效数字)。
(4)下列哪些操作会使测定结果偏高 (填序号)。
A.锥形瓶用蒸馏水洗净后再用待测液润洗
B.酸式滴定管用蒸馏水洗净后再用标准液润洗
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的数值,下列说法正确的( )
A. 常温常压下,22.4L的O2含有分子数为NA
B. 标准状况下,22.4L的SO3含有分子数为NA
C. 标准状况下,17gNH3含有的电子数为8 NA
D. 常温常压下,14gC2H4和C3H6的混合物含原子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10mL0.1mol/L的某一元酸HR溶液中逐滴加入0.1mol/L氨水,所得溶液pH及导电能力变化如图。下列分析不正确的是( )
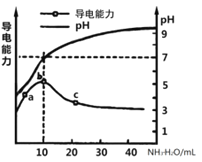
A. a~b点导电能力增强说明HR为弱酸
B. a、b点所示溶液中水的电离程度不相同
C. b恰好完全中和,pH=7说明NH4R没有水解
D. c 点溶液存在c(NH4+)>c(R-)、c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述不正确的是

A. 该装置中电子的流动方向为:铜电极→锌电极
B. 电池工作一段时间后,甲池溶液的总质量不变
C. 电池工作一段时间后,乙池的c(SO42-)不变
D. 溶液中阳离子通过交换膜从负极区向正极区移动保持溶液中电荷平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃,向20mL 0.1mol·L-1MOH溶液中滴加0.1mol·L-1 CH3COOH溶液,所得溶液的pH(对应曲线M)及导电能力(对应曲线N)变化如图所示。下列叙述正确的是( )

A. MOH是强碱
B. b点溶液中,c(CH3COO-)+c(CH3COOH)=0.1 mol·L-1
C. 水的离子积常数Kw:b>c>a
D. c点溶液中,c(CH3COO-)>c(M+)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,U形管内盛有150mL的溶液,按要求回答下列问题:
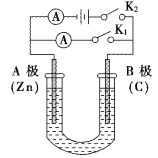
(1)打开K2,闭合K1,若所盛溶液为稀硫酸,则B极为___________极(填电极名称),该装置的能量转化形式为:__________,B极的电极反应式为:______________________。
(2)打开K1,闭合K2,若所盛溶液为NaCl溶液,一段时间后U形管内溶液的pH___________(填“变大”、“不变”或“变小”),总反应的化学方程式是:______________________。若要使U形管内溶液恢复到起始状态,应向U形管内的溶液加入(或通入)___________。
(3)如果要在铁块上镀上铜,打开K1,闭合K2,电解液选用CuSO4溶液,则A电极的材料应换成是___ (填“铁块”或“纯铜”),反应一段时间后电解质溶液中Cu2+的浓度将会_____ (填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W、R在元素周期表中的相对位置如图所示,其中R元素的常见单质为气体,下列判断不正确的是( )
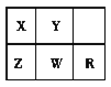
A.原子半径:Z>X> Y
B.非金属性:R>W> Z
C.X、Z对应的含氧酸均为强酸
D.Y的最简单氢化物的沸点比X的高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com