
【题目】中国是钢铁生产大国,也是铁矿石消费大国。某铁矿石主要成分为![]() 和
和![]() ,实验室为测定
,实验室为测定![]() 和
和![]() 的物质的量比,利用下图所示装置进行实验。
的物质的量比,利用下图所示装置进行实验。
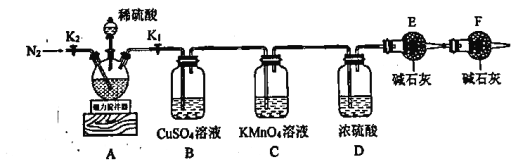
实验步骤如下:
Ⅰ.按图示连接仪器,检查装置气密性后加入药品;
Ⅱ.打开![]() 、
、![]() ,通入一段时间氮气,关闭
,通入一段时间氮气,关闭![]() 、
、![]() ,取下干燥管称量其质量(
,取下干燥管称量其质量(![]() )后再连接好装置;
)后再连接好装置;
Ⅲ.打开![]() 和分液漏斗活塞,向三颈烧瓶中慢慢滴加足量已经除去
和分液漏斗活塞,向三颈烧瓶中慢慢滴加足量已经除去![]() 的稀硫酸(其它杂质与稀硫酸不反应,且无还原性物质),待反应完成后,打开
的稀硫酸(其它杂质与稀硫酸不反应,且无还原性物质),待反应完成后,打开![]() 通入一段时间氮气;
通入一段时间氮气;
Ⅳ.关闭![]() 、
、![]() ,取下三颈烧瓶过滤、洗涤,将滤液与洗涤液合并成100mL溶液备用;
,取下三颈烧瓶过滤、洗涤,将滤液与洗涤液合并成100mL溶液备用;
Ⅴ.取下上述步骤ⅱ中的干燥管并称量其质量(![]() );
);
Ⅵ.取配制好的滤液25mL于锥形瓶中,用![]() 溶液滴定。
溶液滴定。
回答下列问题:
(1)步骤Ⅱ中需要称重的干燥管是_________(填“E”或“F”)。
(2)实验过程中发现B中有黑色沉淀生成,写出装置A中![]() 与稀硫酸反应的化学方程式__________________。
与稀硫酸反应的化学方程式__________________。
(3)C装置的作用是_________;若撤去装置F,则测得的![]() 的含量会_________(填“偏大”“偏小”或“无影响”)。
的含量会_________(填“偏大”“偏小”或“无影响”)。
(4)下列关于步骤Ⅳ的叙述正确的是_________(填标号)。
A.滤渣中含有还原产物单质硫
B.过滤过程中玻璃棒起到引流和搅拌的作用
C.过滤操作要迅速,否则会使测得的![]() 的含量偏低
的含量偏低
D.检验沉淀是否洗涤干净,可向滤液中加入氯化钡溶液,观察是否有白色沉淀生成
(5)步骤Ⅵ中发生反应的离子方程式为_________,到达滴定终点的现象是_________。
(6)若上述实验中![]() ,步骤Ⅵ消耗
,步骤Ⅵ消耗![]() 溶液45mL,则该矿石样品中
溶液45mL,则该矿石样品中![]() _________。
_________。
【答案】E ![]() 除去
除去![]() 并检验
并检验![]() 是否除尽 偏大 C
是否除尽 偏大 C ![]() 滴入最后一滴
滴入最后一滴![]() 溶液,溶液变为紫红色且半分钟不褪去
溶液,溶液变为紫红色且半分钟不褪去 ![]()
【解析】
根据题干信息可知,A装置中发生反应FeS2+H2SO4===FeSO4+S+H2S,FeCO3+H2SO4===FeSO4+CO2↑+H2O,B装置为检验H2S的装置,C装置可除去H2S并检验H2S是否除尽,D装置盛有浓硫酸可除去水蒸气,E装置吸收CO2并测定其质量,F装置可吸收空气中的CO2和H2O,防止进入E装置中影响实验结果,据此分析解答问题。
(1)由上述分析可知,装置E吸收CO2并测定其质量,故步骤Ⅱ中需要称重的干燥管是E,故答案为:E;
(2)B装置为检验H2S的装置,B中有黑色的CuS沉淀生成,则A中FeS2与稀硫酸的反应方程式为FeS2+H2SO4===FeSO4+S+H2S,故答案为:FeS2+H2SO4===FeSO4+S+H2S;
(3)酸性高锰酸钾溶液具有强氧化性,可除去H2S并检验H2S是否除尽,F装置可吸收空气中的CO2和H2O,若撤去装置F,E装置所测得的CO2的质量将会偏大,使得最终FeCO3的含量偏大,故答案为:除去H2S并检验H2S是否除尽;偏大;
(4)A.反应FeS2+H2SO4===FeSO4+S+H2S中FeS2中的S化合价由-1升高至0价,S为氧化产物,故滤渣中含有氧化产物S,A选项错误;
B.过滤过程中玻璃棒的作用是引流,B选项错误;
C.过滤操作要迅速,否则FeSO4被空气中的氧气氧化,Fe2+含量偏低,消耗的KMnO4溶液体积偏小,从而Fe2+总量偏小,FeCO3的量不变,则测得的FeS2含量偏低,C选项正确;
D.检验沉淀是否洗涤干净,应取最后一次洗涤液,向其中加入稀盐酸酸化的BaCl2溶液,观察是否有白色沉淀生成,若有,则未洗涤干净,反之则洗涤干净,D选项错误;
故答案为:C;
(5)步骤Ⅵ中,Fe2+与酸性高锰酸钾溶液发生氧化还原反应生成Mn2+和Fe3+,反应得离子方程式为5Fe2++MnO4-===Mn2++5Fe3++4H2O,反应终点的现象是最后一滴KMnO4溶液滴下时,溶液变为紫红色且半分钟不褪去,故答案为:滴入最后一滴KMnO4溶液时,溶液变为紫红色且半分钟不褪去;5Fe2++MnO4-===Mn2++5Fe3++4H2O;
(6)m1-m2=2.2g,即CO2的质量为2.2g,物质的量为0.05mol,则FeCO3的物质的量为0.05mol,由方程式5Fe2++MnO4-===Mn2++5Fe3++4H2O可知,5Fe2+~MnO4-,n(MnO4-)=0.045L×0.1mol/L=0.0045mol,25mL滤液中,n(Fe2+)=5×0.0045mol=0.0225mol,则100mL滤液中n(Fe2+)=4×0.0225mol=0.09mol,因此n(FeS2)=0.09mol-n(FeCO3)=0.04mol,n(FeS2):n(FeCO3)=0.04:0.05=4:5,故答案为:4:5。


科目:高中化学 来源: 题型:
【题目】成语、古诗词、谚语等都是我国传统文化的瑰宝。下列有关解读错误的是
选项 | 传统文化 | 化学角度解读 |
A | 兰陵美酒郁金香,玉碗盛来琥珀光 | “香”主要因为美酒含有酯类物质 |
B | “司南之杓(勺),投之于地,其柢(勺柄)指南” | 司南中“杓”的材质为Fe2O3 |
C | 三月打雷麦谷堆 | 在雷电作用下N2转化成能被作物吸收的氮元素 |
D | 《本草经集注》记载“如握盐雪不冰,强烧之,紫青烟起…云是真硝石也 | 利用物理方法(焰色反应)可以检验钠盐和钾盐 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置中,可观察到电流计指针偏转,M棒变粗,N棒变细,由此判断下表中所列M、N、P物质,其中可以成立的是( )
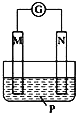
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能作为一种清洁高效的二次能源,在未来能源格局中发挥着重要作用。已知:常温下,![]()
![]()
![]() ,
,![]() 。回答下列问题:
。回答下列问题:
(1)常温下、水的分解不能自发进行的热力学依据是________________________。
(2)将![]() 负载在
负载在![]() 上,产氧温度在1200℃,产氢温度在1000℃时,可顺利实现水的分解,氢气产量高且没有明显的烧结现象。循环机理如下,过程如图1所示,不考虑温度变化对反应
上,产氧温度在1200℃,产氢温度在1000℃时,可顺利实现水的分解,氢气产量高且没有明显的烧结现象。循环机理如下,过程如图1所示,不考虑温度变化对反应![]() 的影响。
的影响。
第Ⅰ步:![]()
![]()
![]()
第Ⅱ步:![]()
![]()
![]()
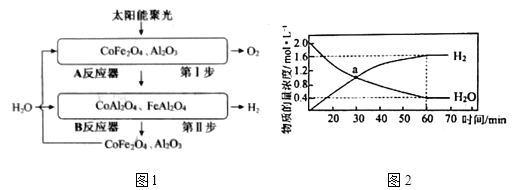
①![]() _________285.84(填“>”“<”或“=”)。第Ⅰ步反应中化合价有变化的元素为________(填名称)。
_________285.84(填“>”“<”或“=”)。第Ⅰ步反应中化合价有变化的元素为________(填名称)。
②第Ⅱ步反应的![]() ,
,![]() ,
,![]() 、
、![]() 分别为正、逆反应速率常数,仅与温度有关。1000℃时,在体积为1L的B反应器中加入2mol
分别为正、逆反应速率常数,仅与温度有关。1000℃时,在体积为1L的B反应器中加入2mol![]() 发生上述反应,测得
发生上述反应,测得![]() 和
和![]() 物质的量浓度随时间的变化如图2所示,则60min内,
物质的量浓度随时间的变化如图2所示,则60min内,![]() _________
_________![]() (保留2位小数)。a点时
(保留2位小数)。a点时![]() ________(填最简整数比);平衡时,体系压强为10kPa,则
________(填最简整数比);平衡时,体系压强为10kPa,则![]() _________。
_________。
(3)热力学铜-氯循环制氢法分电解、水解、热解三步进行。
电解:![]() ;
;
水解:![]() ;
;
热解:![]() 。
。
已知:![]() 为白色固体,
为白色固体,![]() 。
。
电解装置如图所示,则A为________极(填“阳”或“阴”),B极电极反应为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是( )
A.无色透明的溶液中:Fe3+、Mg2+、SCN﹣、Cl﹣
B.c(H+)=10﹣12 molL﹣1的溶液中:K+、Na+、CO![]() 、NO
、NO![]()
C.c(Fe2+)=1 molL﹣1的溶液中:K+、NH![]() 、MnO
、MnO![]() 、SO
、SO![]()
D.能使甲基橙变红的溶液中:Na+、NH![]() 、SO
、SO![]() 、HCO
、HCO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对相关实验的叙述符合事实的是
A.铁与水蒸气在高温下的反应产物为Fe3O4和H2
B.向一小烧杯中分别加入等体积的水和煤油,片刻后再向该烧杯中缓慢地加入一绿豆粒大的金属钠,可能观察到的现象是如图

C.用洁净的铂丝蘸取待测液,置于酒精灯火焰上灼烧,观察到火焰呈黄色,则表明待测液中一定含有Na+而不含K+
D.用坩埚钳夹住铝箔在酒精灯上加热至熔化,轻轻晃动,有液态的铝滴落下来
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在 2L 由 NaCl、MgCl2、CaCl2 组成的混合液中,部分离子浓度大小如图所示,则此溶液中Ca2+离子的物质的量是

A.3.0molB.2.0molC.1.0molD.0.5 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
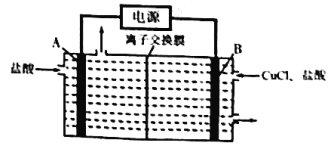
【题目】有一整套电化学装置如右图,关于该装置说法正确的是( )
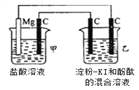
A. 甲池中Mg极为正极,电极反应式为:Mg-2e-═Mg2+
B. 甲池中C电极发生氧化反应
C. 乙池中将化学能转化为电能
D. 乙池左侧石墨电极附近变蓝,右侧石墨电极附近变红
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com