
【题目】CO2与CH4可制得合成气:CH4(g)+CO2(g)2CO(g)+2H2(g) ΔH=+247 kJ·mol-1。初始温度均为T K时,在3个容器中按不同方式投入反应物,发生上述反应,相关信息如下表:
容器 | 起始物质的量/mol | CO2平衡转化率(α) | |||||
编号 | 容积/L | 条件 | CH4(g) | CO2(g) | CO(g) | H2(g) | |
Ⅰ | 2 | 恒温恒容 | 2 | 1 | 0 | 0 | 50% |
Ⅱ | 1 | 0.5 | 1 | 0 | 0 | ||
Ⅲ | 1 | 绝热恒容 | 1 | 0.5 | 0 | 0 | - |
下列说法正确的是
A.T K时,反应CH4(g)+CO2(g)2CO(g)+2H2(g)的平衡常数为1/3
B.容器Ⅱ中反应达到平衡时,α(CO2,Ⅱ)=50%
C.容器Ⅲ中反应达到平衡时反应热在123.5—247 kJ·mol-1范围内
D.容器Ⅱ中反应达到平衡时,再投入0.5 mol CH4、0.25 mol CO,反应达到新平衡前,v(正)<v(逆)
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素:
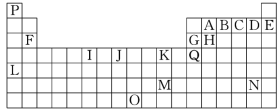
(1)I的最高化合价为________,K的元素名称为________。
(2)基态时Q元素原子的电子排布式_________________________________,J元素原子的外围电子排布式______________________。
(3)下列对比正确的是________。
a.原子半径H>G>B>A b.第一电离能E>D>C>B
c.电负性A>H>G>Q d.最高价氧化物的水化物酸性B>A>H>G
(4)下列关于元素在元素周期表中的位置以及元素原子的外围电子排布特点的有关叙述不正确的是________。
a.L位于元素周期表中第5周期ⅠA族,属于s区元素
b.O位于元素周期表中第7周期ⅧB族,属于d区元素
c.M的外围电子排布式为6s1,属于ds区元素
d.H所在族的外围电子排布式为ns2np2,属于p区元素
(5)由P、A、C三种元素形成的某化合物,对氢气的相对密度为15,则该分子的键角约为________。
(6)元素B和C的气态氢化物热稳定性较强的是________(填化学式)。
(7)K的常见离子和B的最简单氢化物形成的配离子的名称为________,其水溶液颜色为________。Ag和元素K同族,且在K的下一周期,则Ag元素的原子序数为________,Ag也可以和B的最简单氢化物形成配离子,配位数为2,该配离子的符号为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学以不同方案探究Cu粉与FeCl3溶液的反应。
(1)甲同学向FeCl3溶液中加入Cu粉,观察到溶液的颜色变为浅蓝色,由此证明发生了反应,其离子方程式是______________________________________________。
(2)乙同学通过反应物的消耗证明了上述反应的发生:将Cu粉加入到滴有少量KSCN的FeCl3溶液中,观察到溶液红色褪去,有白色沉淀A产生。
① 针对白色沉淀A,查阅资料:A可能为CuCl和CuSCN(其中硫元素的化合价为-2价)中的一种或两种。实验过程如下:

请回答:
Ⅰ. 根据白色沉淀B是__________________(填化学式),判断沉淀A中一定存在CuSCN。
Ⅱ. 仅根据白色沉淀A与过量浓HNO3反应产生的实验现象,不能判断白色沉淀A中一定存在CuSCN,从氧化还原角度说明理由:_______________________________________________________。
Ⅲ. 向滤液中加入a溶液后无明显现象,说明A不含CuCl,则a是________________(填化学式)。
根据以上实验,证明A仅为CuSCN。
② 进一步查阅资料并实验验证了CuSCN的成因,将该反应的方程式补充完整:
_______Cu2+ + _______SCN![]() = _______CuSCN↓ + _______ (SCN)2
= _______CuSCN↓ + _______ (SCN)2
③ 结合上述过程以及Fe(SCN)3 Fe3+ + 3SCN![]() 的平衡,分析(2)中溶液红色褪去的原因:_________________。
的平衡,分析(2)中溶液红色褪去的原因:_________________。
(3)已知(SCN)2称为拟卤素,其氧化性与Br2相近。将KSCN溶液滴入(1)所得的溶液中,观察到溶液变红色,则溶液变红的可能原因是_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2NO2![]() 2NO+O2在密闭容器中反应,达到平衡状态的标志是( )
2NO+O2在密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成nmolO2的同时生成2nmolNO2
②单位时间内生成nmolO2的同时生成2nmolNO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2∶2∶1的状态
④混合气体的颜色不再改变的状态
A.②③B.①④
C.①③④D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中草药秦皮中含有七叶树内酯,其结构简式为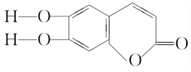 ,具有抗菌作用。若1 mol七叶树内酯分别与浓溴水和NaOH溶液完全反应,则消耗Br2和NaOH的物质的量分别为( )
,具有抗菌作用。若1 mol七叶树内酯分别与浓溴水和NaOH溶液完全反应,则消耗Br2和NaOH的物质的量分别为( )
A. 3 mol、2 mol B. 3 mol、3 mol C. 2 mol、2 mol D. 3 mol、4 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求写热化学方程式:
(1)已知稀溶液中,1 mol H2SO4与NaOH溶液恰好完全反应时,放出114.6 kJ热量,写出表示H2SO4与NaOH反应的中和热的热化学方程式____________________________。
(2)碳的燃烧热为393.50 kJ·mol-1,写出表示C燃烧热的热化学方程式:______________。
(3)已知CO转化成CO2的能量关系如下图所示。写出该反应的热化学方程式:_______。
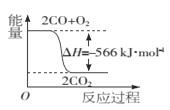
(4)25℃、101 kPa条件下充分燃烧一定量的丁烷气体放出热量为Q kJ,经测定,将生成的CO2通入足量澄清石灰水中产生25 g白色沉淀,写出表示丁烷燃烧热的热化学方程式________。
(5)已知下列热化学方程式:
①CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l) ΔH1=-870.3 kJ/mol
②C(s)+O2(g)===CO2(g) ΔH2=-393.5 kJ/mol
③H2(g)+![]() O2(g)===H2O(l)ΔH3=-285.8 kJ/mol
O2(g)===H2O(l)ΔH3=-285.8 kJ/mol
写出由C(s)、H2(g)和O2(g)化合生成CH3COOH(l)的热化学方程式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的数值。下列叙述正确的是
A.0.5 mol Mg在空气中完全燃烧生成MgO和Mg3N2时,转移的电子数为NA
B.7.8 g Na2O2与足量水反应时,转移的电子数为0.2NA
C.64 g CaC2固体中所含的阴、阳离子总数为3NA
D.密闭容器中充入1 mol H2与1 mol I2反应制备HI时,生成H-I键的数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.室温下,1 L pH=13的NaOH溶液中,由水电离的OH-数目为0.1NA
B.反应 5NH4NO3![]() 2HNO3+4N2↑ +9H2O 中,生成 28 g N2 时,转移的电子数目为3.75 NA
2HNO3+4N2↑ +9H2O 中,生成 28 g N2 时,转移的电子数目为3.75 NA
C.0.1 mo1·L-1 MgCl2溶液中含Cl-数为0.2NA
D.3.9 g Na2O2 晶体中含有的离子总数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼氢化钠(NaBH4)具有优良的还原性,在有机化学和无机化学领域有着广泛的应用。利用硼精矿(主要成分为B2O3,含有少量Al2O3、SiO2、FeCl3等![]() 制取NaBH4的流程如图:
制取NaBH4的流程如图:
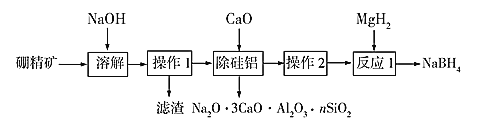
已知:偏硼酸钠(NaBO2)易溶于水,不溶于醇,在碱性条件下稳定存在,回答下列问题:
(1)写出加快硼精矿溶解速率的措施______![]() 写一种
写一种![]() 。
。
(2)操作1为______,滤渣主要成分为______。
(3)除硅铝步骤加入CaO而不加入CaCl2的原因有:①能将硅、铝以沉淀除去;②______.
(4)氢化镁(MgH2)中H元素的化合价为______;MgH2与NaBO2在一定条件下发生反应1,其化学方程式为:______。
(5)如图在碱性条件下,在阴极上电解NaBO2也可制得硼氢化钠,写出阴极室的电极反应式______。
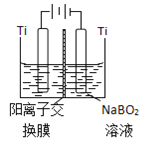
(6)硼氢化钠是一种强还原剂,碱性条件可处理电镀废液中的硫酸铜制得纳米铜,从而变废为宝,写出该反应的离子方程式______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com