
| A. | Fe2+ | B. | Cl- | C. | Mg2+ | D. | Ba2+ |
分析 由于Ba2+与SO42-反应生成BaSO4沉淀,则M不可能为Ba2+,酸性条件下NO3-可以氧化Fe2+,则M也不可能为Fe2+,再根据电荷守恒判断.
解答 解:由于Ba2+与SO42-反应生成BaSO4沉淀,则M不可能为Ba2+,酸性条件下NO3-可以氧化Fe2+,则M也不可能为Fe2+,
设c(NO3-)、c(S042-)、c(Al3+)、c(H+)、c(M)分别为4mol/L、3mol/L、1mol/L、3mol/L、2mol/L,由电荷守恒可知:3c(Al3+)+c(H+)=6mol/L<c(NO3-)+2c(S042-)=10mol/L,故M为阳离子,且M所得电荷数为$\frac{10mol/L-6mol/L}{2mol/L}$=2,故选项中Mg2+符合,
故选:C.
点评 本题考查物质的量浓度计算、离子共存问题,题目难度中等,注意根据电荷守恒判断M应为阳离子,属于易错题目,学生容易考虑电荷守恒,忽略离子共存问题.


 提分百分百检测卷系列答案
提分百分百检测卷系列答案科目:高中化学 来源: 题型:解答题
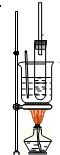 实验室制取硝基苯的方法如图所示:
实验室制取硝基苯的方法如图所示: ,
,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相等 | B. | ②多 | C. | ①多 | D. | 无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用试管加热碳酸氢钠固体时使试管口竖直向上 | |
| B. | 金属钠着火时使用泡沫灭火器灭火 | |
| C. | 验证氯气能否与水反应的实验时,用氢氧化钠溶液处理尾气 | |
| D. | 浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢气在Cl2中燃烧,产生苍白色火焰,瓶口有白雾生成 | |
| B. | 铁丝在Cl2中燃烧,产生棕红色的烟 | |
| C. | 钠在Cl2中燃烧,生成白色的雾 | |
| D. | 铜丝在Cl2中燃烧,生成棕黄色的烟 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属氧化物一定是酸性氧化物 | B. | 碱性氧化物一定是金属氧化物 | ||
| C. | 碱性氧化物都能与水化合生成碱 | D. | 酸性氧化物都能与水化合生成酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 品红溶液褪色---漂白性 | B. | 高锰酸钾溶液褪色---漂白性 | ||
| C. | 导致酸雨---酸性氧化物 | D. | 通入H2S溶液中变浑浊---氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
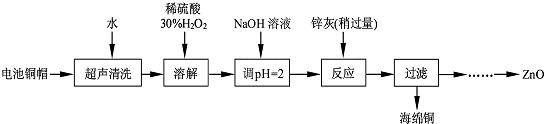
| 实验编号 | 1 | 2 | 3 | 4 |
| V(Na2S2O3)(mL) | 28.32 | 25.31 | 25.30 | 25.32 |
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 8.9 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com