
【题目】如图所示为一定条件下含碘物质在水溶液中的转化关系图:

(1)转化①中的氧化剂是_____(填化学式)
(2)转化①②③中,碘元素发生氧化反应的是_____(填序号)
(3)转化③中,Cl2发生反应后可能生成以下物质中的_____(填字母)。
A HCl B HClO C.HClO4
(4)转化②的化学方程式为KIO3+KOH+SO2→I2+K2SO4+H2O(未配平)
①配平反应②并用双线桥法表示电子转移的情况_______________
②每生成1.27gI2,反应中转移电子的物质的量为_____
【答案】Cl2 ①③ A 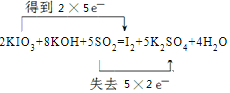 0.05mol
0.05mol
【解析】
(1)转化①为氯气与KI的反应,生成KCl和碘;
(2)①中I元素化合价由-1价升高到0价,②中I元素化合价由+5价降低到0价,③中I元素化合价由-1价升高到+5价;
(3)氯气与KI反应生成KIO3,氯气被还原,化合价由0价降低为-1价;
(4)反应KIO3+KOH+SO2→I2+K2SO4+H2O中,I元素化合价由+5价降低为0价,S元素化合价由+4价升高到+6价,结合化合价的变化解答。
(1)转化①为氯气与KI的反应,生成KCl和碘,氯气被还原,为氧化剂,故答案为:Cl2;
(2)①中I元素化合价由﹣1价升高到0价,②中I元素化合价由+5价降低到0价,③中I元素化合价由﹣1价升高到+5价,碘元素发生氧化反应的是①③,故答案为:①③;
(3)氯气与KI反应生成KIO3,氯气表现氧化性,被还原,化合价由0价降低为﹣1价,只有A符合,故答案为:A;
(4)①反应KIO3+KOH+SO2→I2+K2SO4+H2O中,I元素化合价由+5价降低为0价,S元素化合价由+4价升高到+6价,反应的方程式为2KIO3+8KOH+5SO2=I2+5K2SO4+4H2O,用双线桥法表示电子转移的情况可表示为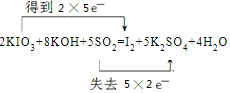 ,
,
故答案为: ;
;
②生成1.27gI2,物质的量为![]() =0.005mol,则转移的电子为0.005mol×2×(5﹣0)=0.05mol,
=0.005mol,则转移的电子为0.005mol×2×(5﹣0)=0.05mol,
故答案为:0.05mol。


 优生乐园系列答案
优生乐园系列答案科目:高中化学 来源: 题型:
【题目】某混合溶液中,可能大量含有的离子如下表:

将Na2O2逐渐加入上述混合解液中并微热,产生沉淀和气体的物质的量与加入Na2O2的物质的量的关系分别如下图所示。

回答下列问题:
(1)将上述混合溶液中一定大量含有的阴、阳离子及其物质的量填入下表(可以不填满,也可以增加):_________
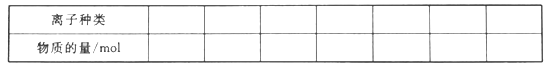
(2)图中a=_________,6=_________,c=_________
(3)简述溶液中还可能大量含有的离子的鉴定方法:_________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,此装置可用来制取和观察Fe(OH)2在空气中被被氧化的颜色变化。实验时必须使用铁屑和6molL-1的硫酸,其他试剂任选。填写下列空白:

(1)B中盛有一定量的NaOH溶液,A中应预先加入的药品是__。A中反应的离子方程式是__。
(2)实验开始时先将活塞a__(填“打开”或“关闭”)。
(3)简述生成Fe(OH)2的操作过程:__。
(4)实验完毕,打开b处活塞,放入一部分空气,此时B瓶中发生的反应为__。
(5)下列各图示中,___能较长时间看到Fe(OH)2白色沉淀。(填序号)
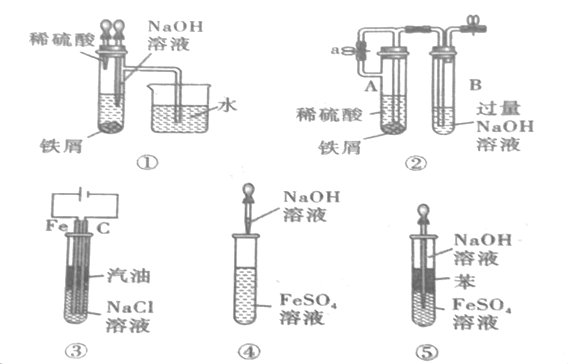
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列盐溶液中能发生水解的用离子方程式表示,不能发生水解的请写上“不发生水解”字样并说明溶液的酸碱性:
(1)CH3COONa _____,溶液呈___性;
(2)BaCl2 ______,溶液呈______性;
(3)CuCl2 _____,溶液呈_____性。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Y形管是一种特殊的仪器,与其他仪器组合可以进行某些实验探究。利用如图装置可以探究SO2与BaCl2反应生成BaSO3沉淀的条件。下列判断正确的是

A. e、f两管中的试剂可以分别是浓氨水和NaOH固体
B. 玻璃管的作用是连通大气,使空气中的氧气进入广口瓶,参与反应
C. c、d两根导管都必须插入BaCl2溶液中,保证气体与Ba2+充分接触
D. Y形管乙中产生的为氧化性气体,将BaSO3氧化为BaSO4沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图所示的实验装置,回答下列问题:
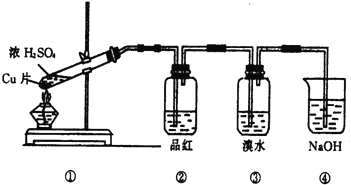
(1)写出铜与浓硫酸反应的化学方程式
(2)证明SO2具有漂白性的现象是 ,再加热该溶液,现象是 .
(3)装置③中的现象是 ,证明SO2具有 .
(4)装置④的作用是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制Cl2的反应为4HCl(浓)+MnO2![]() MnCl2+Cl2↑+2H2O.下列说法错误的是( )
MnCl2+Cl2↑+2H2O.下列说法错误的是( )
A. 还原剂是HCl,氧化剂是MnO2
B. 每生成1 molCl2,转移电子的物质的量为2 mol
C. 每消耗1 molMnO2,起还原剂作用的HCl消耗4mol
D. 生成的Cl2中,除含有一些水蒸气外,还含有HCl杂质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图容器底部是培养基,其中含有植物生长所需的全部养分,如果有人在配制培养基的矿质元素中使用了NH4NO3、KNO3、CaCl2·2H2O、MgSO4·7H2O、螯合铁溶液、微量元素溶液,但缺少了一种必需元素,为补充这种元素,应添加的化合物是( )

A.Ca(NO3)2B.KClC.KH2PO4D.K2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)青奥会将于2014年8月在南京举行。青奥会建筑设施使用了大量节能材料,体现了“绿色青奥”的理念。
①用于青奥村工程的隔热保温材料聚氨酯属于______(填字母)。
a.有机高分子材料 b.无机非金属材料 c.金属材料
②青奥中心外墙的复合保温材料采用铝合金锁边。有关铝合金的性质正确的是___(填字母)。
a.强度小 b.耐腐蚀 c.密度大
③青奥会议中心双塔采用了玻璃幕墙设计。制造玻璃的主要原料为纯碱、石灰石和___(填字母)。
a.金刚砂 b.石英 c.水玻璃
(2)如图为某品牌酱油标签的一部分。

①氨基酸态氮的含量是酱油质量的重要指标,这些氨基酸是由大豆中的主要营养物质_____水解而来的。
②配料清单中属于防腐剂的是______。
③小麦中的主要营养物质是_____,写出这种物质完全水解的化学方式:______。
(3)A、B、C三个城市全年雨水的月平均pH变化如图所示。
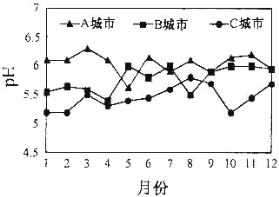
①受酸雨危害最严重的是____城市。
②导致硫酸型酸雨形成主要气体是___,减少燃煤过程产生该气体的措施有_________。
③汽车尾气中含有NO2、NO、CO等有害气体。写出由NO2形成硝酸型酸雨的化学方程式:______;汽车安装尾气净化装置可将NO、CO转化为无害气体,写出该反应的化学方程式:_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com