
| A. | 仅有② | B. | 仅有②④ | C. | 仅有③④ | D. | ①②③④ |
分析 含元素化合价变化的物质为氧化剂,含元素化合价升高的物质为还原剂,
①只有Na2O2中O元素的化合价变化,为氧化剂、还原剂;
②只有S元素的化合价变化,S为氧化剂、还原剂;
③只有C元素的化合价变化,C为还原剂、氧化剂;
④HCl为还原剂,MnO2为氧化剂,且4molHCl反应时只有2mol作还原剂.
解答 解:①只有Na2O2中O元素的化合价变化,为氧化剂、还原剂,由反应及原子守恒可知,氧化剂与还原剂的物质的量之比为1:1,故不选;
②只有S元素的化合价变化,S为氧化剂、还原剂,氧化剂与还原剂的物质的量之比为2:1,故不选;
③只有C元素的化合价变化,C为还原剂、氧化剂,由反应及原子守恒可知,氧化剂与还原剂的物质的量之比为1:2,故选;
④HCl为还原剂,MnO2为氧化剂,且4molHCl反应时只有2mol作还原剂,由反应及原子守恒可知,氧化剂与还原剂的物质的量之比为1:2,故选;
故选C.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素化合价变化、基本概念为解答的关键,侧重分析与应用能力的考查,注意原子守恒的应用,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
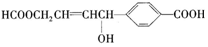 性质叙述正确的是( )
性质叙述正确的是( )| A. | 1 mol该有机物可以与3 mol Na发生反应 | |
| B. | 1 mol该有机物可以与3 mol NaOH发生反应 | |
| C. | 1 mol该有机物可以与6 mol H2发生加成反应 | |
| D. | 1 mol该有机物分别与足量Na或NaHCO3反应,产生的气体在相同条件下体积相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
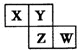 X、Y、Z、W均为短周期元素:在周期表中位置如图,Y原子的最外层电子数是其次外层电子数的3倍.下列说法正确的是( )
X、Y、Z、W均为短周期元素:在周期表中位置如图,Y原子的最外层电子数是其次外层电子数的3倍.下列说法正确的是( )| A. | X、Y、Z的原子半径大小:X>Y>Z | |
| B. | Y、Z的气态氢化物的热稳定性:Y<Z | |
| C. | Z、W的最高价氧化物对应水化物的酸性:Z<W | |
| D. | X、W的气态氢化物相互反应,生成物中既含离子键又含极性键和非极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烷烃在任何情况下均不与强酸、强碱、氧化剂反应 | |
| B. | 乙烯使酸性高锰酸钾溶液和溴的四氯化碳溶液褪色的反应类型相同 | |
| C. | 等质量的乙烯和丁烯完全燃烧,丁烯耗氧多 | |
| D. | 相对分子质量相近的醇比烷烃沸点高是因为醇分子间存在氢键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将苯滴入溴水中,振荡后水层接近无色 | |
| B. | 乙烯使酸性KMnO4溶液褪色 | |
| C. | 甲烷与氯气混合,光照一段时间后黄绿色消失 | |
| D. | 乙烯使溴的四氯化碳溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作 | 主要仪器 |
| A | 称取3.0g干海带 | 托盘天平 |
| B | 灼烧干海带至完全变成灰烬 | 烧杯 |
| C | 过滤煮沸后的海带灰与水的混合液 | 漏斗 |
| D | 用四氯化碳从氧化后的海带灰浸取液中提取碘 | 分液漏斗 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用铜片、铅笔芯作电极插入稀硫酸中 | |
| B. | 用两个铜片作电极插入硝酸银溶液中 | |
| C. | 用锌片、铜片作电极插入酒精中 | |
| D. | 用铜片、铁片作电极插入柠檬汁中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com