
| 10×80×m×(V2-V1) |
| & |
| 80m(V2-V1) |
| w |
| 80m(V2-V1) |
| w |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
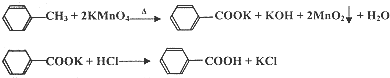
| 第一次 | 第二次 | 第三次 | 第四次 | |
| 体积(mL) | 24.00 | 24.10 | 22.40 | 23.90 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
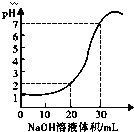 如图为10mL x mol?L-1的盐酸用y mol?L-1的NaOH溶液滴定的图象,依据图象推出x和y的数值可能是下列各组中的( )
如图为10mL x mol?L-1的盐酸用y mol?L-1的NaOH溶液滴定的图象,依据图象推出x和y的数值可能是下列各组中的( )| A | B | C | D | |
| x | 0.12 | 0.04 | 0.03 | 0.09 |
| y | 0.04 | 0.12 | 0.09 | 0.03 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
 核磁共振氢谱有
核磁共振氢谱有查看答案和解析>>
科目:高中化学 来源: 题型:

| NaOH.H2O |
| △ |
| 氧化 |
| 氧化 |
 与1分
与1分 在一定条件下可发生类似反应①的反应,生成有机化合物Ⅵ,Ⅵ的结构简式为
在一定条件下可发生类似反应①的反应,生成有机化合物Ⅵ,Ⅵ的结构简式为查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com