
铁单质及其化合物在生活、生产中应用广泛.请回答下列问题:
(1)钢铁在空气中发生吸氧腐蚀时,正极的电极反应式为________.
(2)由于氧化性Fe3+>Cu2+,氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式是________.
(3)硫酸铁可作絮凝剂,常用于净水,其原理是________(用离子方程式表示).在使用时发现硫酸铁不能使酸性废水中的悬浮物沉降而除去,其原因是________.
(4)磁铁矿是工业上冶炼铁的原料之一,其原理是Fe3O4+4CO![]() 3Fe+4CO2,若有1.5 mol Fe3O4参加反应,转移电子的物质的量是________.
3Fe+4CO2,若有1.5 mol Fe3O4参加反应,转移电子的物质的量是________.
(5)下表中,对陈述Ⅰ、Ⅱ的正确性及其有无因果关系的判断都正确的是________(填字母).
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
 (2011?万州区一模)Ⅰ、铁单质及其化合物在生活生产中应用广泛.如硫酸铁可作絮凝剂,常用于净水,其原理是(用离子方程式表示)
(2011?万州区一模)Ⅰ、铁单质及其化合物在生活生产中应用广泛.如硫酸铁可作絮凝剂,常用于净水,其原理是(用离子方程式表示) Fe(OH)3+3H+
Fe(OH)3+3H+ Fe(OH)3+3H+
Fe(OH)3+3H+查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
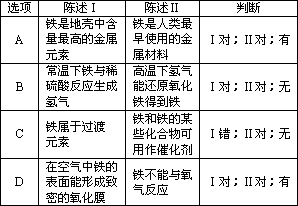
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 | A | 铁是地壳中含量最高的 金属元素 |
铁是人类最早使用的金属材料 | Ⅰ对;Ⅱ对;有 | B | 常温下铁与稀硫酸反应 生成氢气 |
高温下氢气能还原氧化 铁得到铁 |
Ⅰ对;Ⅱ对;无 | C | 铁属于过渡元素 | 铁和铁的某些化合物可用作催化剂 | Ⅰ错;Ⅱ对;无 | D | 在空气中铁的表面能形 成致密的氧化膜 |
铁不能与氧气反应 | Ⅰ对;Ⅱ对;有 |
查看答案和解析>>
科目:高中化学 来源:2012年人教版高中化学必修一3.2 几种重要的金属化合物练习卷(解析版) 题型:填空题
铁单质及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为3FeS2+8O2 6SO2+Fe3O4,3 mol
FeS2参加反应转移________mol
电子。
6SO2+Fe3O4,3 mol
FeS2参加反应转移________mol
电子。
(2)氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式为
________________________________________________________________________。
从腐蚀废液回收得到金属铜还需要的试剂为
________________________________________________________________________。
(3)与明矾相似,硫酸铁也可用作絮凝剂,在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是____________________________________________________ 。
(4)下表中,对陈述Ⅰ、Ⅱ的正确性及其有无因果关系的判断都正确的是________(填字母)。
|
选项 |
陈述Ⅰ |
陈述Ⅱ |
判断 |
|
A |
铁是地壳中含量最高的金属元素 |
铁是人类最早使用的金属材料 |
Ⅰ对;Ⅱ对;有 |
|
B |
常温下铁与稀硫酸反应生成氢气 |
高温下氢气能还原氧化铁生成铁 |
Ⅰ 对;Ⅱ对;无 |
|
C |
铁属于过渡元素 |
铁和铁的某些化合物可以用作催化剂 |
Ⅰ 错;Ⅱ对;无 |
|
D |
铁在空气中表面生成致密氧化膜 |
可用铁罐储存运输浓硫酸、浓硝酸 |
Ⅰ 对;Ⅱ对;有 |
查看答案和解析>>
科目:高中化学 来源:2011-2011年广东省高二上期第一次建档考试化学试卷 题型:填空题
铁单质及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为:3FeS2+8O2 6SO2+Fe3O4,3 mol FeS2参加反应转移
mol电子。
6SO2+Fe3O4,3 mol FeS2参加反应转移
mol电子。
(2)氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式 。
从腐蚀废液回收得到金属铜还需要的试剂为__________ _______________。
(3)与明矾相似,硫酸铁也可用作絮凝剂,在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是 。
(4)下表中,对陈述I、II的正确性及其有无因果关系的判断都正确的是__ __。(填字母)
|
选项 |
陈述I |
陈述II |
判断 |
|
A |
铁是地壳中含量最高的金属元素 |
铁是人类最早使用的金属材料 |
I对;II对;有 |
|
B |
常温下铁与稀硫酸反应生成氢气 |
高温下氢气能还原氧化铁生成铁 |
I对;II对;无 |
|
C |
铁属于过渡金属元素 |
铁和铁的某些化合物可以用作催化剂 |
I错;II对;无 |
|
D |
铁在空气中表面生成致密氧化膜 |
可用铁罐储存运输浓硫酸、浓硝酸 |
I对;II对;有 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com