
| A. | 烧碱、纯碱、熟石灰都是碱 | B. | 铝土矿、水玻璃、小苏打都是混合物 | ||
| C. | Na2O、Al2O3、Fe2O3都是碱性氧化物 | D. | H2SO4、KOH、NaCl都是电解质 |
分析 A.电离时生成的阴离子都是氢氧根离子的化合物是碱;
B.不同物质组成的为混合物;
C.和酸反应生成盐和水的氧化物为碱性氧化物;
D.水溶液中或熔融状态下导电的化合物为电解质.
解答 解:A.烧碱、熟石灰都是碱,纯碱是碳酸钠属于盐,故A错误;
B.铝土矿氧化铁、氧化铝、二氧化硅等政策的混合物、水玻璃为硅酸钠的水溶液都是混合物,小苏打是碳酸氢钠为纯净物,故B错误;
C.Na2O、Fe2O3都是碱性氧化物,Al2O3是两性氧化物,故C错误;
D.H2SO4、KOH、NaCl水溶液中都可以电离能导电,都是电解质,故D正确;
故选D.
点评 本题考查了物质的分类,最基础的化学知识之一,对基本概念的正确理解,了解概念间的本质区别和联系是解决问题的关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
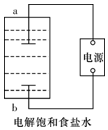 某兴趣小组模拟氯碱工业生产原理并探究其产品的性质.已知文献记载:
某兴趣小组模拟氯碱工业生产原理并探究其产品的性质.已知文献记载:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④ | B. | ②③④⑤ | C. | ①②③④ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
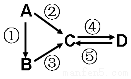 A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如下的反应关系:
A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如下的反应关系:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠和冷水反应:Na+2H2O═Na++2OH-+H2↑ | |
| B. | 用小苏打治疗胃酸过多:HCO3-+H+═CO2↑+H2O | |
| C. | 氯化铝溶液中加入过量氨水:Al3++3OH-═Al(OH)3↓ | |
| D. | 三氯化铁溶液中加入铁粉:Fe3++Fe═2 Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不溶物一定是铜 | B. | 不溶物一定是铁 | ||
| C. | 不溶物中一定含铜,但不一定含铁 | D. | 滤液中可能含有CuSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ql>Q2 | |
| B. | 反应物总能量均高于生成物总能量 | |
| C. | 1molHBr(g)具有的能量大于1molHBr(l)具有的能量 | |
| D. | 反应①生成2 molHCl(l)时放出Q1热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com