
| 族 周期 | IA | 0 | ||||||
| 1 | ① | IIA | IIIA | IVA | VA | VIA | VIIA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
| 3 |
| 1 |
| 14 |
| 14 |
| ||
| ||
| 3 |
| 1 |
| 14 |
| 14 |
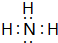 ,氨气与氧气反应生成NO与水,反应方程式为:4NH3+5O2
,氨气与氧气反应生成NO与水,反应方程式为:4NH3+5O2
| ||
| △ |
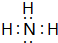 ;4NH3+5O2
;4NH3+5O2
| ||
| △ |


科目:高中化学 来源: 题型:
| A、氧化性最强:B2 |
| B、还原性最强:X- |
| C、X2与B-一定不能发生反应 |
| D、X2与A-一定不能发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验操作 | 现象 |
| a.取少量粉末,加水,振荡 | 全部溶解,溶液无色透明 |
| b.向所得溶液中慢慢滴入氢氧化钠溶液并加热 | 无明确现象 |
| c.取少量粉末,加盐酸 | 粉末溶解,无其它明显现象 |
| d.取少量粉末,加稀H2SO4和稀硝酸混合液 | 有白色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
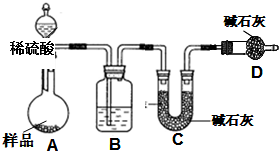
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属性 Li<Na |
| B、非金属性 O>S |
| C、还原性 Mg<Al |
| D、得电子能力 Se>As |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com