
分析 分子晶体中含范德华力,同种非金属元素之间形成非极性共价键;
含离子键或离子的晶体为离子晶体,一般来说,活泼金属与非金属形成离子键;
分子晶体熔化克服分子间作用力,离子晶体熔化破坏离子键,原子晶体熔化只破坏共价键.
解答 解:①白磷(P4)属于分子晶体,只含磷磷键,既有范德华力,又有非极性键;
②水晶主要成分为二氧化硅,属于原子晶体,熔化时只破坏共价键;
③氯化铵有离子键和极性共价键,熔化破坏离子键;
④氢氧化钙有离子键和极性共价键,熔化破坏离子键;
⑤氟化钠有离子键,熔化破坏离子键;
⑥过氧化钠中有离子键和非极性共价键,熔化破坏离子键;
⑦干冰为固态二氧化碳,熔化破坏分子间作用力;
故答案为:①;⑤;②.
点评 本题主要考查化学键、晶体类型,把握化学键与晶体判断的一般规律即可解答,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
 某学生用NaOH标准溶液滴定未知浓度的盐酸,进项了如下实验:
某学生用NaOH标准溶液滴定未知浓度的盐酸,进项了如下实验:| 实验次数 | 待测盐酸体积(mL) | 标准氢氧化钠溶液体积(mL) | ||
| 初读数 | 末读数 | 消耗体积 | ||
| 1 | 15.00 | 0.50 | 17.75 | 17.25 |
| 2 | 15.00 | 0.05 | 16.10 | 16.05 |
| 3 | 15.00 | 0.00 | 15.95 | 15.95 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HBr、CO2、H2O、CS2 | B. | Cl2、Na2S、HCl、SO2 | ||
| C. | NaCl、HCl、H2O、NaOH | D. | Na2O2、H2O2、H2O、O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应物具有的总能量总是高于生成物所具有总能量 | |
| B. | 需要加热方能发生的反应一定是吸热反应 | |
| C. | 构成原电池的正极和负极必须是两种不同的金属 | |
| D. | 决定化学反应速率的主要因素是参加反应的物质的性质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 布洛芬属于丁苯丙酸的一种,是世界卫生组织推荐的獐抗炎退烧药,其结构如图所示.下列说法不正确的是( )
布洛芬属于丁苯丙酸的一种,是世界卫生组织推荐的獐抗炎退烧药,其结构如图所示.下列说法不正确的是( )| A. | 布洛芬的分子式为C12H18O2 | B. | 布洛芬与苯丙酸互为同系物 | ||
| C. | 丁苯丙酸共有12种可能的结构 | D. | 布洛芬能发生加成、取代等反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
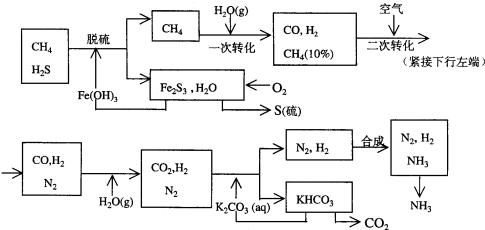
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 30% | B. | 37% | ||
| C. | 50% | D. | 数据不全无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用pH试纸检测,氨水溶液呈碱性:NH3•H2O=NH4++OH- | |
| B. | 100℃时,测得纯水中c(H+)•c(OH-)=3.8×10-13 H2O(l)?H+(aq)+OH-(aq)△H<0 | |
| C. | FeCl3溶液中通入适量SO2,溶液黄色褪去:Fe3++SO2+2H2O=Fe2++SO42-+4H+ | |
| D. | 用CaSO4治理盐碱地:CaSO4(s)+Na2CO3(aq)?CaCO3(s)+Na2SO4(aq) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com