
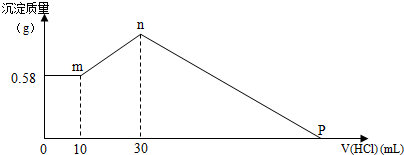
分析 (1)先分段分析图象,分析每段图象所表示的溶液中溶质成分是什么,然后结合方程式、原子守恒求出NaOH、氯化铝的质量;
(2)分析P点溶液中的溶质成分,再次结合方程式,得氢氧化钠与盐酸物质的量相等来求出盐酸的体积.
解答 解:(1)向所得浊液中,逐滴加入0.5mol/L盐酸,由加入盐酸的体积和生成沉淀的质量关系图分析:
①0-10mL,随盐酸的体积增加,生成沉淀的质量不变,说明沉淀是Mg(OH)2,m[Mg(OH)2]=0.58g,NaOH、AlCl3、MgCl2组成的混合物,溶于足量水发生反应是:MgCl2+2NaOH=Mg(OH)2↓+2NaCl;AlCl3+4NaOH=NaAlO2+3NaCl+2H2O,NaOH有剩余,溶液是NaCl、NaAlO2和NaOH的混合液,该阶段发生反应是:NaOH+HCl=NaCl+H2O;
②10mL处,加入10ml盐酸刚好中和未反应的NaOH,溶液为NaCl、NaAlO2;
③10mL-30ml,随盐酸的体积增加,生成沉淀的质量增加,该阶段发生反应是:NaAlO2+HCl+H2O=Al(OH)3↓+NaCl;
④30mL处,NaAlO2与盐酸恰好反应,需盐酸体积为:30ml-10ml=20ml,沉淀质量达到最大,溶液为NaCl溶液;
⑤30mL-P点,随盐酸的体积增加,沉淀的质量减少,发生反应是:Mg(OH)2+2HCl=MgCl2+2H2O、Al(OH)3+3 HCl=AlCl3+3H2O;
⑥P点,Mg(OH)2和Al(OH)3完全反应,溶液为MgCl2、AlCl3和NaCl混合液,
选30mL处,计算NaOH的质量,此时溶液为NaCl溶液,溶液中Cl-来源于原混合物中的AlCl3、MgCl2和加入的30mlHCl,溶液中Na+来源于原混合物中的NaOH,
NaAlO2+HCl+H2O=Al(OH)3↓+NaCl
0.01mol 0.02L×0.5mol/L=0.01mol
由Al原子守恒得原混合物中n(AlCl3)=n(NaAlO2)=0.01mol,氯化铝的质量为:133.5g/mol×0.01mol=1.335g;
由Mg原子守恒得原混合物中n(MgCl2)=n[Mg(OH)2]=$\frac{0.58g}{58g/mol}$=0.01mol,
由Na+离子和Cl-离子守恒得:n(NaOH)=n(NaCl)=n(Cl-)=2n(MgCl2)+3n(AlCl3)+n(HCl)=0.01mol×2+0.01mol×3+0.03L×0.5mol/L=0.065mol,
所以原混合物中NaOH的质量为:m(NaOH)=0.065mol×40g/mol=2.6g,
故答案为:2.6;1.335;
(2)液为MgCl2、AlCl3和NaCl混合液,P点所加盐酸相等于用于中和原混合物中的NaOH,
此时所加盐酸物质的量:n(HCl)=n(NaOH)=0.065mol,
P点所表示盐酸的体积为:V=$\frac{0.065mol}{0.5mol/L}$=0.13L=130mL,
故答案为:130.
点评 本题考查了有关混合物反应的计算,题目难度中等,明确每段图象发生的方程式、拐点表示的含义及每个拐点表示的溶液中溶质的成分为解答关键,注意掌握守恒思想的应用,试题培养了学生的化学计算能力.


 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | N2O | B. | NO | C. | NO2 | D. | N2O4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在100℃、101 kPa条件下,液态水的气化热为40.69 kJ•mol-1,则H2O(g)?H2O(l) 的△H=40.69 kJ•mol-1 | |||||||||||
| B. | Li、Be、B三种元素的第一电离能(I1)差别不大,而I2差别很大,则三种原子中最难失去第二个电子的是Be | |||||||||||
| C. | 已知:
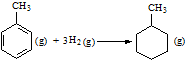 的△H为-384 kJ•mol-1 的△H为-384 kJ•mol-1 | |||||||||||
| D. | 固体NH5的所有原子的最外层均满足2个或8个电子的稳定结构,它与水反应的化学方程式为NH5+H2O═NH3•H2O+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 肯定有Fe2+,可能有Fe3+ | B. | 只有Fe2+,没有Fe3+和Cu2+ | ||
| C. | 可能有Fe3+,可能有Cu2+ | D. | 肯定有Fe2+,可能有Fe3+、Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
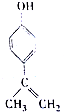
| A. | 该物质的分子式是C9H11O | |
| B. | 该物质分子中的所有C原子可以共面 | |
| C. | 滴入KMnO4(H+)溶液,可观察到紫色褪去,能证明结构中存在碳碳双键 | |
| D. | 1mol该物质分别与浓溴水和H2反应时,最多消耗Br2和H2分别是3mol、4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1的Na2CO3溶液中离子浓度关系:c (Na+)=2c (CO32-)+c (HCO3-)+c (H2CO3) | |
| B. | 0.1 mol•L-1的NH4Cl和0.1 mol•L-1的NH3•H2O等体积混合后溶液中的离子浓度关系:c (Cl-)>c (NH4+)>c (H+)>c (OH-) | |
| C. | 常温下,醋酸钠溶液中滴加少量盐酸使溶液的pH=7,则混合溶液中,离子浓度关系:c (Na+)=c (CH3COO-) | |
| D. | 0.1 mol•L-1的NaHS溶液中离子浓度关系:c (OH-)=c (H+)-c (S2-)+c (H2S) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5mol | B. | $\frac{5}{3}$mol | C. | $\frac{5}{6}$mol | D. | $\frac{2}{5}$mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com