

| A. | X、Y两种单质在常温下反应生成的产物为碱性氧化物 | |
| B. | Z2R3可由Y2R和ZCl3的溶液反应制取 | |
| C. | Y、Z、R三种元素对应的最高价氧化物的水化物相互之间可以发生反应 | |
| D. | 电解熔融的X与Z构成的化合物可以得到单质Z |
分析 同周期自左而右原子半径减小,同主族自上而下原子半径增大,故前7种元素处于第二周期,后7种元素处于第三周期,由原子序数可知,X为O元素,Y为Na元素,Z为Al元素,R为S元素,
A.X、Y两种单质在常温下反应生成的产物为氧化钠,能和酸反应只生成盐和水的氧化物为碱性氧化物;
B.Al2S3可在水溶液中易发生双水解;
C.Y、Z、R三种元素对应的最高价氧化物的水化物分别是NaOH、Al(OH)3、H2SO4,氢氧化铝是两性氢氧化物,能和酸、碱反应生成盐和水;
D.X、Z构成的化合物是氧化铝,工业上用电解熔融氧化铝的方法冶炼铝.
解答 解:同周期自左而右原子半径减小,同主族自上而下原子半径增大,故前7种元素处于第二周期,后7种元素处于第三周期,由原子序数可知,X为O元素,Y为Na元素,Z为Al元素,R为S元素,
A.X、Y两种单质在常温下反应生成的产物为氧化钠,能和酸反应只生成盐和水的氧化物为碱性氧化物,氧化钠和酸反应只生成盐和水,则氧化钠是碱性氧化物,故A正确;
B.Al2S3可在水溶液中易发生双水解,所以不能在水溶液中制取硫化铝,故B错误;
C.Y、Z、R三种元素对应的最高价氧化物的水化物分别是NaOH、Al(OH)3、H2SO4,氢氧化铝是两性氢氧化物,能和酸、碱反应生成盐和水,氢氧化钠和稀硫酸发生中和反应,所以Y、Z、R三种元素对应的最高价氧化物的水化物相互之间可以发生反应,故C正确;
D.X、Z构成的化合物是氧化铝,铝是亲氧元素,较活泼,工业上用电解熔融氧化铝的方法冶炼铝,故D正确;
故选B.
点评 本题考查原子结构和元素周期律,为高频考点,明确原子结构、元素周期表结构、物质性质是解本题关键,侧重考查学生分析判断及应用能力,注意规律中的反常现象,易错选项是D.


科目:高中化学 来源: 题型:解答题
 ,很多不饱和有机物在E催化下可与H2发生加成反应:如①CH2=CH2、②HC≡CH、③
,很多不饱和有机物在E催化下可与H2发生加成反应:如①CH2=CH2、②HC≡CH、③ 、④HCHO.其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质)加成产物CH3OH分子之间能形成氢键.
、④HCHO.其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质)加成产物CH3OH分子之间能形成氢键.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
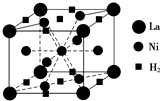 能源、材料和信息是现代社会的三大“支柱”.
能源、材料和信息是现代社会的三大“支柱”.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
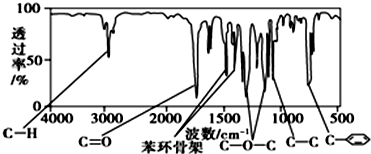
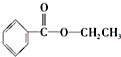 、
、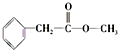 ;
;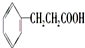 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
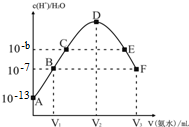
| A. | E溶液中存在:c(NH4+)>c(SO42-)>c(OH-)>c(H+) | |
| B. | 稀硫酸的浓度为0.1mol/L | |
| C. | C点溶液pH=14-b | |
| D. | V2=20 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5 9 6 | B. | 5 6 6 | C. | 3 9 7 | D. | 4 6 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | d元素的非金属性最强 | |
| B. | 它们均存在两种或两种以上的氧化物 | |
| C. | 只有a与题中其他元素生成的化合物都是离子化合物 | |
| D. | c、d形成的气态氢化物的还原性:d>c |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com