
| A. | 在铁件上镀铜时,金属铜作阳极 | |
| B. | 实验室制氢气用粗锌比用纯锌速率快 | |
| C. | 电解精炼铜时,粗铜电极上每转移0.2 mol e-,阴极析出6.4 g Cu(忽略能量损失) | |
| D. | 甲醇和氧气以及KOH溶液构成的新型燃料电池中,负极反应为:CH3OH+6OH--6e-═CO2+5H2O |
分析 A、电镀时,镀层作阳极,镀件作阴极;
B、根据原电池能加快化学反应速率来回答;
C、阳极材料为粗铜,有比铜活泼的金属先放电,阴极上是铜离子得电子的还原反应;
D、甲醇燃料电池是碱性环境,负极是燃料失电子的氧化反应.
解答 解:A、电镀铜时,铜作阳极,阳极上铜失电子发生氧化反应,镀件作阴极,阴极上铜离子放电生成铜,故A正确;
B、锌与硫酸反应生成氢气,粗锌和硫酸形成原电池,原电池能加快化学反应速率,故B正确;
C、阳极材料为粗铜,有比铜活泼的金属先放电,粗铜电极上每转移0.2mole-,阴极上是铜离子得电子发生还原反应,得到金属铜是6.4g,故C正确;
D、甲醇和氧气以及KOH溶液构成的新型燃料电池中,负极上发生的反应为:CH3OH+8OH--6e-═CO32-+6H2O,故D错误.
故选D.
点评 本题考查原电池,明确原电池的应用是解题的关键,题目难度不大.


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 产物B的状态只能为固态或液态 | |
| B. | 平衡时,单位时间内n(A)消耗﹕n(C)消耗=1﹕1 | |
| C. | 若开始时向容器中加入1molB和1molC,达到平衡时放出热量等于Q kJ | |
| D. | 保持体积不变,向平衡体系中加入A,平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氟是非金属性最强的元素.
氟是非金属性最强的元素.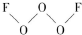 ,其中氧原子采用的轨道杂化方式是sp3,又如O2F2是一种强氧化剂,运用VSEPR模型判断O2F2是极性(填“极性”或“非极性”)分子.
,其中氧原子采用的轨道杂化方式是sp3,又如O2F2是一种强氧化剂,运用VSEPR模型判断O2F2是极性(填“极性”或“非极性”)分子.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡向正反应方向移动 | B. | x+y>z | ||
| C. | C的体积分数增大 | D. | B的转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0mol•L-1 | B. | 0.8mol•L-1 | C. | 0.6mol•L-1 | D. | 0.4mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
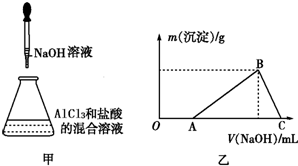 某同学称取一定质量的AlCl3固体配成溶液,在该溶液中加入一定量的稀盐酸,然后向此混合溶液中逐滴加入NaOH溶液如图甲所示.滴加过程中产生沉淀的质量与加入NaOH溶液的体积的关系如图乙所示.
某同学称取一定质量的AlCl3固体配成溶液,在该溶液中加入一定量的稀盐酸,然后向此混合溶液中逐滴加入NaOH溶液如图甲所示.滴加过程中产生沉淀的质量与加入NaOH溶液的体积的关系如图乙所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
| 溶解度/g | 122 | 216 | 311 | 440 | 585 | 733 |
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
| 溶解度/g | 122 | 216 | 311 | 440 | 585 | 733 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com