
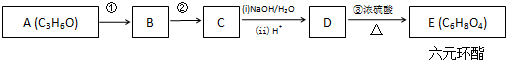
 +2H2O.
+2H2O. 分析 D能够生成6元环酯E,说明D中含有羧基和羟基,据题给信息C→D是卤素原子转化为羟基的过程;A的分子中不含甲基,且能使溴水褪色,联系A的分子式以及A→B→C的转化可知,A为CH2=CHCH2OH,羟基氧化为羧基时,碳碳双键也能够被氧化,所以首先让碳碳双键与Cl2加成生成CH3CHClCH2OH,B为CH3CHClCH2OH,B再氧化羟基成羧基生成C,C为CH3CHClCOOH,C在NaOH水溶液中反应生成的D为CH3CH(OH)COOH,2molD通过酯化反应生成六元环E,E为 ,据此分析.
,据此分析.
解答 解:(1)D能够生成6元环酯E,说明D中含有羧基和羟基,据题给信息C→D是卤素原子转化为羟基的过程;A的分子中不含甲基,且能使溴水褪色,联系A的分子式以及A→B→C的转化可知,A为CH2=CHCH2OH,羟基氧化为羧基时,碳碳双键也能够被氧化,所以首先让碳碳双键与Cl2加成生成CH3CHClCH2OH,B为CH3CHClCH2OH,B再氧化羟基成羧基生成C,C为CH3CHClCOOH,C在NaOH水溶液中反应生成的D为CH3CH(OH)COOH,故答案为:CH2=CHCH2OH;CH3CH(OH)COOH;
(2)A为CH2=CHCH2OH,羟基氧化为羧基时,碳碳双键也能够被氧化,所以首先让碳碳双键与Cl2加成生成CH3CHClCH2OH,故答案为:加成反应;
(3)D为CH3CH(OH)COOH,2molD通过酯化反应生成六元环E,E为 ,化学方程式为2CH3CH(OH)COOH$?_{△}^{浓硫酸}$
,化学方程式为2CH3CH(OH)COOH$?_{△}^{浓硫酸}$ +2H2O,
+2H2O,
故答案为:2CH3CH(OH)COOH$?_{△}^{浓硫酸}$ +2H2O.
+2H2O.
点评 本题考查有机物的推断,需要学生对给予的信息进行利用,注意以E为突破口综合分析有机物分子式进行推断,需要学生熟练掌握官能团的性质,题目难度较大.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
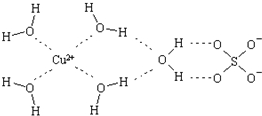 科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如下,其中配位键和氢键均采用虚线表示.
科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如下,其中配位键和氢键均采用虚线表示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
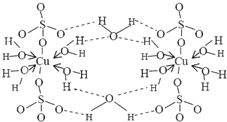 波尔多液是一种保护性杀菌剂,广泛应用于树木、果树和花卉上,鲜蓝色的胆矾晶体是配制波尔多液的主要原料.胆矾CuSO4?5H2O可写成[Cu(H2O)4]SO4?H2O,其结构示意图如图:
波尔多液是一种保护性杀菌剂,广泛应用于树木、果树和花卉上,鲜蓝色的胆矾晶体是配制波尔多液的主要原料.胆矾CuSO4?5H2O可写成[Cu(H2O)4]SO4?H2O,其结构示意图如图: ,与铜同周期的所有元素的基态原子中最外层电子数与铜原子相同的元素有K、Cr(填元素符号).
,与铜同周期的所有元素的基态原子中最外层电子数与铜原子相同的元素有K、Cr(填元素符号).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
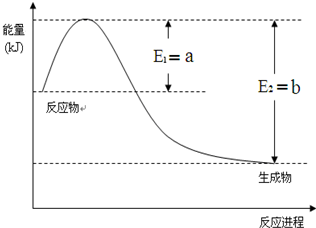 运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义
运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义查看答案和解析>>
科目:高中化学 来源: 题型:解答题
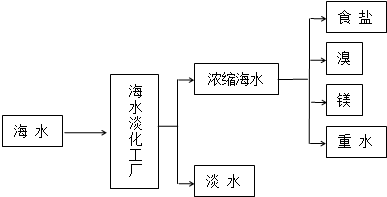
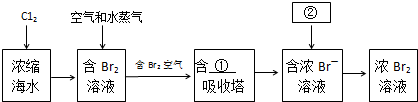
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,0.1molCl2溶于水,转移的电子数目为0.1NA | |
| B. | 常温常压下,7.8gNa2S和Na2O2固体中含有的阴离子总数为0.1NA | |
| C. | 5.6gFe与标准状况下2.24L氯气充分反应失去电子数为0.3NA | |
| D. | 标准状态下,33.6L氟化氢中含有氟原子的数目为1.5NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com