
 科研人员对某岛上山泉水进行分析化验,结果显示山泉水属于硬水.
科研人员对某岛上山泉水进行分析化验,结果显示山泉水属于硬水.分析 (1)硬水是含有较多可溶性钙盐、镁盐的水,硬水中的碳酸氢钙受热分解生成碳酸钙沉淀;
(2)依据硬度为1°的水是指每升水含10mgCaO或与之相当的物质(如7.1mgMgO),将水中的Ca2+、Mg2+质量折算成CaO的质量计算得到;
(3)聚丙烯酸钠的单体为丙烯钠;
(4)铝离子水解生成氢氧化铝和氢离子,氢氧化铝具有吸附性能够吸附杂质颗粒,可以用来净水;
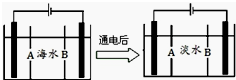
(5)①阴离子交换膜只允许阴离子自由通过,阳离子交换膜只允许阳离子自由通过;
②根据阳极是氯离子放电,阴极区是氢离子得到电子生成氢气,氢氧根离子浓度增大.
解答 解:(1)硬水是含有较多可溶性钙盐、镁盐的水,硬水中的碳酸氢钙受热分解生成碳酸钙沉淀,方程式为:Ca2++2HCO3-$\frac{\underline{\;\;△\;\;}}{\;}$CaCO3↓+CO2↑+H2O;
故答案为:可溶性钙盐、镁盐;Ca2++2HCO3-$\frac{\underline{\;\;△\;\;}}{\;}$CaCO3↓+CO2↑+H2O;
(2)某天然水中c(Ca2+)=1.2×10-3mol•L-1,c(Mg2+)=6×10-4mol•L-1,硬度为1°的水是指每升水含10mgCaO或与之相当的物质(如7.1mgMgO);1L水中钙离子物质的量=1.2×10-3mol,相当于CaO质量=1.2×10-3mol×56g/mol=67.2mg,1L水中镁离子物质的量=6×10-4mol,相当于氧化镁质量6×10-4mol×40g/mol=24mg,水的硬度=$\frac{67.2mg}{10mg}$+$\frac{24mg}{7.1mg}$=10°,属于硬水;
故答案为:是;
(3)聚丙烯酸钠的单体为丙烯钠,结构简式:CH2=CHCOONa,
故答案为:CH2=CHCOONa;
(4)铝离子水解生成氢氧化铝和氢离子,离子方程式:Al3++3H2O?Al(OH)3(胶体)+3H+,
故答案为:Al3++3H2O?Al(OH)3(胶体)+3H+;
(5)①阴离子交换膜只允许阴离子自由通过,阳离子交换膜只允许阳离子自由通过,隔膜B和阴极相连,阴极是阳离子放电,所以隔膜B是阳离子交换膜,
故答案为:B;
②根据阳极是氯离子放电:2Cl--2e-═Cl2↑,阴极区是氢离子得到电子生成氢气,氢氧根离子浓度增大,和钙离子,镁离子形成沉淀,
故答案为:2Cl--2e-═Cl2↑;电极上产生气泡,溶液中出现白色沉淀.
点评 本题考查了化学和生活,涉及硬水及其软化,明矾净水等,明确相关概念及电解原理是解题关键,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 石油的分馏和煤的干馏都属于物理变化 | |
| B. | 通过对95%的酒精直接蒸馏获得无水酒精 | |
| C. | 在石油的分馏、实验室制乙烯以及制备硝基苯的三个实验中,温度计水银球的位置分别位于蒸馏烧瓶支管口、反应液液面以下、水浴中 | |
| D. | 用C8H18萃取溴水中的溴,可观察到溶液分层,下层为橙红色,上层接近无色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
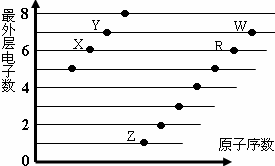
| A. | 元素非金属性:X>R>W | |
| B. | X与R形成的分子内含两种作用力 | |
| C. | X、Z形成的化合物中可能含有共价键 | |
| D. | 元素对应的离子半径:W>R>X |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一分子H2和Cl2反应,放出热量184.6 kJ | |
| B. | 1mol H2和Cl2完全反应生成2mol HCl放出的热量为184.6kJ | |
| C. | 在25℃、101kPa时,1mol气态H2和1mol气态Cl2完全反应生成2mol HCl气体,放出的热量为184.6 kJ | |
| D. | 在25℃、101kPa时,1mol气态H2和1mol气态Cl2完全反应生成2mol HCl气体,吸收的热量为184.6kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,6.0gNO和2.24LO2混合,所得气体的分子数目为0.2NA | |
| B. | 常温常压下,1 L0.1mol•L-1的硝酸铵溶液中氮原子数目为0.2NA | |
| C. | 1 mol有机物 中最多有6 NA个原子在一条直线上 中最多有6 NA个原子在一条直线上 | |
| D. | 1 mol甲基( 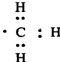 )所含的电子数为7 NA )所含的电子数为7 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
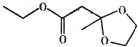
| A. | 苹果酯分子中含有14个氢原子 | |
| B. | 苹果酯能在NaOH溶液中发生水解反应 | |
| C. | 苹果酯能与金属钠反应产生氢气 | |
| D. | 苹果酯与C2H5OOCCH2CH2COOC2H5互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
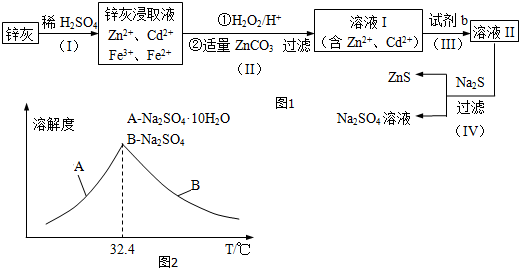
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素H的单质存在H2、D2、T2三种同素异形体 | |
| B. | 在该反应条件下,H2的还原性强于Fe的还原性 | |
| C. | 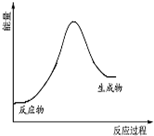 该反应的能量变化关系可以用如图表示 | |
| D. | 1molFe与水蒸气完全反应转移的电子数为3×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水溶性:SO2>Cl2>CO2 | B. | 酸性:HClO4>H2SO4>H3PO4 | ||
| C. | 稳定性:NH3>H2O>HF | D. | 沸点:F2<Cl2<Br2<I2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com